网址:http://m.1010jiajiao.com/timu_id_914387[举报]
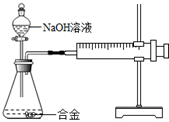 合金在生活中应用十分广泛.已知某合金粉末除含金属铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含金属铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑(其中,NaAlO2溶于水,溶液呈无色)
【进行猜想】
猜想1:该合金粉末中除铝外,还含有铁;
猜想2:该合金粉末中除铝外,还含有
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】
下列实验(见下表)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.实验记录:
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的 |
粉末部分溶解,并有无色气体放出,形成无色溶液 | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量 |
滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 |
【拓展】下列可用于小明验证铝、铁、铜三种金属的活动性强弱的一组药品是
A.Fe、Cu、Al(NO3)3溶液 B.Al、Fe、Cu、稀盐酸
C.Al、Cu、FeSO4溶液 D.Cu、Al(NO3)3溶液、FeSO4溶液.
合金在生活中应用十分广泛。已知某合金粉末除含金属铝外,还含有铁、铜中的一种或两种。小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动。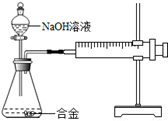
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应。
(2)铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑(其中,NaAlO2溶于水,溶液呈无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁;
猜想2:该合金粉末中除铝外,还含有 ;
猜想3:该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验(见下表)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液。
实验记录:
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的 ,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出,形成无色溶液 | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量 ,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 |
【得出结论】猜想3成立。
【拓展】下列可用于小明验证铝、铁、铜三种金属的活动性强弱的一组药品是
A.Fe、Cu、Al(NO3)3溶液 B.Al、Fe、Cu、稀盐酸
C.Al 、Cu、FeSO4溶液 D.Cu、Al(NO3)3溶液、FeSO4溶液 查看习题详情和答案>>
合金在生活中应用十分广泛。已知某合金粉末除含金属铝外,还含有铁、铜中的一种或两种。小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动。

【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应。
(2)铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑(其中,NaAlO2溶于水,溶液呈无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁;
猜想2:该合金粉末中除铝外,还含有? ????????? ;
猜想3:该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验(见下表)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液。
实验记录:
实验步骤 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的? ??? ? ,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出,形成无色溶液 | 合金中一定含有 ? |
②取步骤①所得滤渣,加过量? ??? ? ,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有? |
【得出结论】猜想3成立。
【拓展】下列可用于小明验证铝、铁、铜三种金属的活动性强弱的一组药品是??????
A.Fe、Cu、Al(NO3)3溶液????????????? B.Al、Fe、Cu、稀盐酸
C.Al 、Cu、FeSO4溶液????????????????? D.Cu、Al(NO3)3溶液、FeSO4溶液
查看习题详情和答案>>
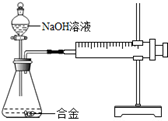
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应。
(2)铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑(其中,NaAlO2溶于水,溶液呈无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁;
猜想2:该合金粉末中除铝外,还含有 ;
猜想3:该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验(见下表)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液。
实验记录:
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的 ,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出,形成无色溶液 | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量 ,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 |
【得出结论】猜想3成立。
【拓展】下列可用于小明验证铝、铁、铜三种金属的活动性强弱的一组药品是
A.Fe、Cu、Al(NO3)3溶液 B.Al、Fe、Cu、稀盐酸
C.Al 、Cu、FeSO4溶液 D.Cu、Al(NO3)3溶液、FeSO4溶液
已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气
(2Al+2H2O+2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、Na0H溶液、氨水。
请你参与并完成以下实验探究过程:
Ⅰ、提出假设 假设1:该混合金属粉末中除铝外还含有Fe。
假设2:该混合金属粉末中除铝外还含有 _________。
假设3:该混合金属粉末中除铝外还含有Fe、Cu。
Ⅱ、设计并实施实验方案
(1)基于假设1,不用化学试剂,证明金属铁的存在可用 ____________ 。
(2)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是
_____________,反应的化学方程式为 ___________。
(3)基于假设3,请你完成实验操作,描述实验现象。
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再用滴管滴加 ,充分反应后,静置,弃去清液得到 固体。 | 固体粉末 , 并有 。 | 仅除去铝 |
| ② | 再往大试管中加 ,充分反应。 | 固体 , 溶液 。 | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
Ⅲ、已知该金属粉末的组成为铝和铁、铝和铜两种情况。
(1)为测定混合金属粉末中铝的质量分数,将5.6 g的金属粉末中加入100 g某溶质质量分数的稀硫酸,恰好完全反应,并产生a g氢气,则下列说法正确的是 ( )
A.当粉末为Al 、Fe时,a可能为0.2 g
B.当粉末为Al、Cu时,反应完全后,生成物的溶液里一定含有Al2(SO4)3和CuSO4
C.当粉末为Al、Cu时,若a为0.3g,则该种粉末中含铝的质量分数小于50%
D.当粉末为Al、Fe时,所需稀硫酸溶质质量分数一定大于9.8%
(2)若5.6 g粉末为铝和铜,加入97.6 g足量的稀硫酸,完全反应生成氢气0.3 g,求所得Al2(SO4)3溶液质量分数(Al2(SO4)3相对分子质量为342,要求有计算过程。
查看习题详情和答案>>