2009年辽宁中考综合复习训练化学试题(二)
理化考试时间l50分钟 化学试卷满分65分
可用到的相对原子质景:C ―l2 O―l6 Na―23
一、选择题(本题包括l3道小题,l―11小题每小题1分;l2、13小题每小题2分;共15分。每小题有一个最符合题目要求的选项,请选出后将其序号填在题后的括号内)
1.下列选项中物质的名称、俗名、化学式一致的是 ( )
A.铁锈 氧化铁 Fe2O3 B.氢氧化钙 熟石灰 Ca(OH)2
C.氧化钙石灰石
2.2008年的理化实验操作考核,其中一组实验题目是:测定苹果中是否含有葡萄糖。下面是实验过程中的主要操作,其正确的是 ( )

3.下图悬实验室里一瓶标签破损的无色液体,某同学对瓶中液体是什么物质做了如下猜想,你认为他的猜想不合理的是 ( )
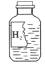
A.水 B.稀硫酸 C.盐酸 D.过氧化氢溶液
4.联合国卫生组织经过严密的科学分析,认为我们的铁锅是最理想的炊具,并向全世界大力推广。其主要原因是 ( )
A.价格便宜 B.烹饪的食物中留有铁元素
C.铁的导热性好 D.铁锅中含有碳元素
5.碳酸氢钠是一种白色固体,俗称小苏打,化学式为NaHCO3,碳酸氢钠受热会分解成碳酸钠(Na2CO3)、二氧化碳和水,常用做食品加工中的膨松剂。上述对碳酸氢钠的描述中没有涉及的是 ( )
A.物理性质 B.化学性质 C.用途 D.制法
6.有机合成材料的出现是材料发展史上一次重大突破,下列物质中,属于有机合成材料的是 ( )
A.玻璃 B.玻璃钢 C.棉花 D.有机玻璃
7.赫然同学利用下图装置测定空气中氧气的含量,红磷燃烧后恢复到室温。打开弹簧夹发现进入广口瓶的液体液面高度超过广口瓶容积的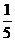 。造成这一现象的原因可能是( )
。造成这一现象的原因可能是( )
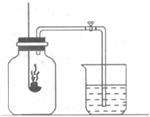
A.实验前没有将弹簧夹夹紧 B.实验装置可能漏气
C.实验中所取的红磷过量 D.实验中所取的红磷不足
8.石灰浆新抹的墙壁上掉下一块白色固体,小文为探究其成分,她应选用的试剂是( )
A.酚酞试液、氢氧化钠试液 B.酚酞试液、稀盐酸
C.酚酞试液、氯化钠溶液 D.盐酸、氢氧化钠溶液
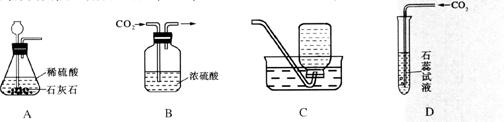
9.下列所示分别是二氧化碳的制取、干燥、收集和性质检验的装置图,其中错误的是( )
10.某探究小组利用下图所示装置进行四组实验,胶头滴管盛放的是液体,烧瓶中盛装是气体、固体或液体,当用胶头滴管向烧瓶中滴几滴液体后,能观察到气球会变大的实验组合是 ( )
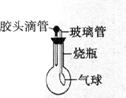
组合
滴管中
烧杯中
A
H2O
CaO(固)
B
HCl
Zn(固)
C
NaOH
CO2气体(气)
D
浓H2SO4
H2O(液)
11.对实验现象的观察和分析,有助于获得化学知识并学会科学探究的方法。下列对实验现象的分析科学的是( )
A.向某无色溶液中滴入酚酞溶液,呈红色,证明该溶液一定是碱溶液
B.向某无色溶液中滴入硝酸银溶液,产生白色沉淀,证明该溶液是盐酸
C.某物质完全燃烧产生一种能使澄清石灰水变浑浊的气体和水,证明该物质的组成中一定含有碳、氢、氧三种元素
D.把燃着的木条插入无色气体中,火焰熄灭,该气体可能是二氧化碳
12.现有①液态氧;②铁锈;③食盐水;④小苏打;⑤氢氧化钾;⑥石油。对上述物质的分类全部正确的是 ( )
A.盐――③④ B.纯净物――④⑤⑥
C.碱――④⑤ D.混合物――②③⑥
13.对下列实验事实的解释正确的是 ( )
实验事实
解释
A
长期盛放氢氧化钠溶液的试剂瓶口,出现白色粉末
氢氧化钠发生了潮解
B
硫在空气里燃烧,发出微弱的淡蓝色火焰;
在氧气里燃烧.发出蓝紫色火焰
硫和氧气反应,氧气的相对含量不同,
反应的剧烈程度不同,现象不同
C
某化肥加熟石灰研磨,没有嗅到氨昧
无氨气放出,一定不是氮肥
D
冬天在汽车水箱里加入少量乙二醇后,水箱中不易结冰
加入乙二醇后,使水温升高
二、填空题(本题包括4道小题,每空1分,共14分)
14.空气是一种重要的自然资源,空气中的各种成分可以广泛用于生产和生活中。其中氮气约占空气总体积的_________,是工业上生产硝酸和化肥的重要原料;人类维持生命不可缺少的气体是____________,这种气体与体内的葡萄糖(C6H12O6)发生反应,提供人体所需的能量,该反应的化学方程式为__________________________________________;空气中___________________是植物进行光合作用不可缺少的气体。
15.有Ca、Na、C、O、H、Cl六种元素,按下列要求将上述元素中组成物质的化学符号或组成物质涉及反应的化学方程式填入空格内。
(1)能除去发酵后面团中的酸,这种物质是___________________________;
(2)用于配制波尔多液农药的一种碱,这种物质是_____________________________;
(3)用于食品调味和防腐的物质,这种物质中的阴离子是__________________________;
(4)用天然气作燃料,其化学反应方程式是_________________________________。
16.(分)人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是____________;
(2)根据下图金属应用实例推断,金属具有的物理性质是_________________________;

(3)日常使用的金属材料多属于合金。下表列出了一些常见合金的主要成分和性能;
合金
合金的主要性能
主要成分及纯金属的性质
焊锡
熔点
锡:熔点
硬铝
强度和硬度好
铝、铜、镁等,硬度小,质软
不锈钢
抗腐蚀性好
铁、铬、镍等,纯铁抗腐蚀性不如不锈钢
由上表推断,与组成合金的纯金属相比,合金的优点一般有(填序号)______________;
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性更好
(4)人们每年要从金属矿物资源中提取数以亿吨计的金属。根据所学化学知识,请写出一个有金属生成的化学方程式:_____________________________________________。
17.A是一包白色固体,其成分是NaCl和少量难溶于水的杂质。

X中肯定存在的溶质有_______________,可能存在的溶质有_____________________。
三、简答题(本题包括5道小题,共22分)
18.(分)旅游是人们休闲度假的一种方式。请回答下列问题:
(1)去高海拔地区旅游,有的人会感到呼吸困难,这时需要补充_____________;
(2)篝火晚会上,常将燃着的木柴架空,其理由是_______________________________;
(3)篝火晚会结束时,必须将火熄灭,可采用的一种方法是_______________________。
19.(5分)王一同学做实验时发现,盛放NaOH溶液的试剂瓶口与橡皮塞上常有白色粉末出现。为探究这种白色粉末的成分,设计了如下实验。请根据实验完成后面各题。
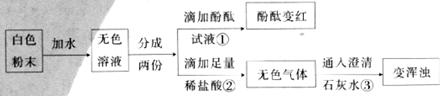
(1)由实验①可知,无色溶液显___________性;由实验②③可知,氢氧化钠变质后生成的白色粉末中一定含有的物质是____________(填化学式);
(2)写出实验③中反应的化学方程式__________________________________________;
(3)通过上述实验你认为氢氧化钠溶液变质的原因是__________;你认为该实验方案有何不足?__________________________________________。
20.(5分)在实验里常采用过氧化氢和二氧化锰混合的方法制取氧气。请回答下列问题:(1)反应的化学方程式为________________________________;
(2)用下图所给仪器可以组装出多套氧气的发生装置和收集装置。请你组装一套制取氧气的发生装置和收集装置,写出所选择的仪器编号________________;
(3)简要说明你组装的气体发生装置的优点________________________;
(4)用你组装的装置收集氧气,如何知道氧气已收集满?
_________________________________________________________________________;
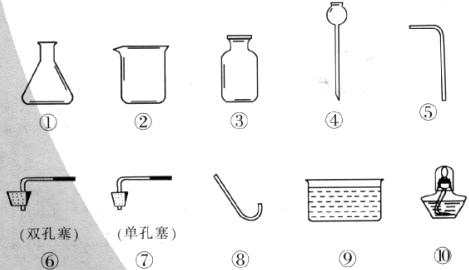
(5)这套气体发生装置也可以用来制取二氧化碳。如果选用碳酸钠粉末和稀盐酸来制取二氧化碳,为了控制反应速率,应对该气体发生装置如何改进?(可另增仪器)____________。
21.(6分)下图为小超同学探究Fe、Cu、Ag三种金属活动性顺序的四个实验。
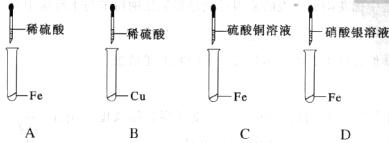
(1)上述实验中,有气体产生的是(填写装置序号)_________________;
(2)我国古代“湿法冶金”就是利用了C装置中的反应原理。请写出该反应的化学方程式____________________________________________________________________________;
(3)通过上述四个实验,还不能证明Fe、Cu、Ag三种金属的活动性顺序,原因是_____________________________________________________________________。
请你在此基础上补充一个实验帮助小超同学达到实验目的.在下框图中填写出你所选择的药品;
(4)若由你来设计此方案,使用最少种类的试剂完成这个实验,所选试剂为_______。
22.(3分)某化工厂排出的废液中,可能含有硫酸钠、硫酸、氢氧化钠、氨酸钠中的一种或几种。初三化学课外活动小组的同学对废液进行了如下实验:
(1)取废液少许静置后观察,上层为无色澄清溶液,将其分为两份;
(2)向其中一份滴加氯化钡溶液,有白色沉淀产生,再加稀硝酸,白色沉淀不消失;
(3)向另一份中加入铁粉,有大量气泡产生。从以上实验可以分析、判断,废液中肯定含有的物质是(填写化学式,下同)_______________;肯定不含有的物质是_________;不能确定是否含有的物质是____________________________。
四、探究题(本题包括1道小题,共8分)
23.(分)在学校的新年联欢会上,思科同学表演了“水能生火”的魔术。
(1)他将少量超氧化钠(NaO2)粉末用棉花包裹时,没有任何变化。(提示:棉花和超氧化钠不反应)
(2)接着他将少量水滴到超氧化钠粉末的棉花上,棉花就剧烈燃烧起来,且比空气中燃烧更旺。
同学们对这个实验很感兴趣,他们走进实验室进行探究。
【提出猜想】实验中棉花剧烈燃烧的原因可能是超氧化钠粉末与水反应中有(1)___________________气体产生和(2)_____________________放出。
【设计实验】同学们设计了如图所示装置,来探究上述猜想。
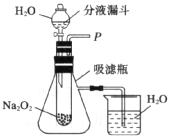
【步骤及现象】
(1)打开分液漏斗的活塞,控制滴加水的速度观察到超氧化钠粉末表面有大量气泡产生。此时烧饼内的现象是_______________,证明猜想(2)正确;
(2)为证明猜想(1),他们继续进行的操作是___________________,观察到的现象是________________,证明猜想(1)正确。
【思考与应用】(1)写出超氧化钠与水反应生成一种气体和另一种化合物的化学方程式____________________________________ __;
(2)实验室应怎样保存超氧化钠_________ _________;
(3)我们知道,宇宙飞船和潜水艇中常用到超氧化钠,请推测超氧化钠的一种用途是___________________________ _。
五、计算题(本题包括l道小题,共6分)
24.(6分)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取
滴加盐酸的次数
第一次
第二次
第三次
第四次
烧杯及所盛物质总质量/g
181.2
204.4
228.6
253.6
请你据此分析计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是_________g;
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)