2007年南通市初中毕业、升学考试
化学
可能用到的相对原子质量: H-
Ca-40 Fe-56
第Ⅰ卷(选择题 共40分)
一、选择题(本题共15小题,每小题2分,共30分)每小题给出的四个选项中只有一个选项正确,请将正确选项的序号填涂在答题卡上。
1.下列做法不符合“节能降耗、保护环境”这一主题的是
A.合理和综合利用煤和石油 B.研制开发太阳能电池、海洋电池等
C.大量使用农药化肥提高粮食产量 D.推广垃圾的分类存放、回收和处理
2.下列说法正确的是
A.分子是化学变化中的最小微粒 B.原子失去电子后变成阴离子
C.元素间最本质的区别是中子数不同 D.分子、原子、离子都可以直接构成物质
3.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。从组成分类来看,Na2SO4不属于
A.化合物 B.氧化物 C.硫酸盐 D.钠盐
4.打火机给人们生活带来方便,右图是普通电子打火机的实物照片。下面可以做到符合燃烧条件能打火的组合是
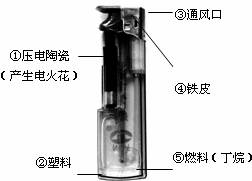
A.①③⑤ B.①③④ C.①②③ D.①②④
5.一种新型高效净水剂PAFC(聚合氯化铁铝,化学式为[AlFe(OH)nCl6-n]m),是以工业生产废料为原料制取的,广泛应用于工业污水的处理。该净水剂中铁元素的化合价为
A.
0
B. +
6.据报导,科学家发现了新的氢微粒。这种氢微粒由3个氢原子核(只含质子)和2个电子构成。下列说法中正确的是
A.该微粒不显电性 B.该微粒比一个普通H2分子相对分子质量多3
C.该微粒的组成可用H3 表示 D.该微粒比一个普通H2分子多一个氢原子核
7.空气是一种宝贵资源。下列有关空气的说法正确的是
A.空气中含量最多的是氧元素
B.空气由氧气和氮气组成,其中氧气的质量约占空气质量的1/5
C.空气中分离出的氮气化学性质不活泼,可作食品保鲜的保护气
D.空气质量报告中所列的空气质量级别数目越大,空气质量越好
8.造成酸雨的主要物质是
A.甲烷和一氧化碳 B.二氧化硫和二氧化氮
C.一氧化碳和二氧化碳 D.二氧化硫和一氧化碳
9.下列物质在空气中完全燃烧只生成水的是
A.氢气 B.天然气 C.酒精 D.汽油
10.氧气跟世间万物如影随形。下列关于氧气说法正确的是
A.氧气从淡蓝色液体变成无色气体发生了化学变化
B.硫在氧气中燃烧产生淡蓝色火焰,并有无色刺激性气味气体产生
C.氧气可用于动植物呼吸、医疗急救、作燃料切割金属等
D.用带火星的木条可以检验氧气
11.NaCl和KNO3溶解度曲线如下图所示,下列说法正确的是
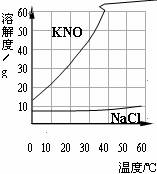
A.KNO3的溶解度大于NaCl的溶解度
B.KNO3的溶解度随温度的升高而增大
C.
D.NaCl溶液的溶质质量分数与KNO3溶液的溶质质量分数不可能相等
12.下列有关物质用途说法中,正确的是
①用稀硫酸清除钢铁表面的铁锈 ②用碳酸氢钠作焙制糕点的发酵粉
③用氢氧化钠中和胃中过多盐酸 ④用熟石灰中和硫酸工厂的污水
A.①②④ B.①②③ C.②③④ D.①②③④
13.下列各组物质鉴别方法不正确的是
A.用肥皂水鉴别硬水和软水 B.用灼烧的方法鉴别羊毛和合成纤维
C.用碱鉴别铵盐和钾肥 D.根据外观和是否溶于水鉴别食盐和亚硝酸钠
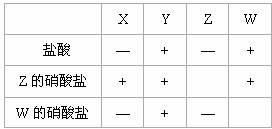
14.X、Y、Z、W是四种不同的金属,为比较金属活动性的大小,某同学利用这四种金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能反应的记为“+”,不能反应的记为“―”,无标记的表示未做该实验)。这四种金属的活动性顺序为

15.小羽从试剂商店购得一瓶质量分数为30%的双氧水,配制
A.
C.
二、选择题(本题共5小题,每小题2分,共10分)每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分。请将正确选项的序号填涂在答题卡上。
16.科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,下图为其计算机模拟图。

下列说法正确的是
A.水结成“热冰”的过程中原子个数发生变化
B.上述变化过程中分子间间隔没有发生变化
C.在弱电场下,水分子运动从无序转变为有序
D.利用该性质,人们在常温常压下可建成溜冰场
17.分析推理是化学学习和研究中常用的思维方法。下列分析推理正确的是
A.水能灭火,所以酒精一旦燃烧应立即用水浇灭
B.有机物中都含有碳元素,所以含碳的化合物都是有机物
C.二氧化碳通入紫色石蕊试液后溶液变红,说明二氧化碳具有酸性
D.硝酸铵溶于水吸热,说明硝酸铵溶解时吸收热量大于放出热量
18.现欲将粗盐提纯,并用制得的精盐配制质量分数一定的氯化钠溶液。下列说法正确的是
A.粗盐溶解时,可边加粗盐边用玻璃棒搅拌加速溶解
B.蒸发滤液时,待蒸发皿中滤液蒸干停止加热
C.配制溶液需要经过计算、称量、溶解、装液等步骤
D.配制溶液时必备的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等
19.在化学反应A2 + BC = B + A
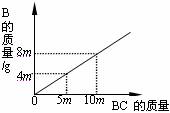
A.
|
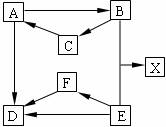


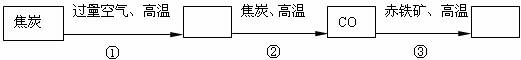
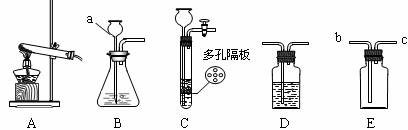
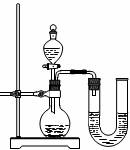
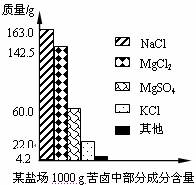
 (2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为
(2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为