摘要:22.我们周围的物质世界是由100多种元素组成的.为了便于研究元素的性质和用途.也需要寻求它们之间的内在规律性.为此.科学家根据元素的结构和性质.将它们科学有序排列成元素周期表的形式.下表是元素周期表中的一部分.表中的元素是人体生命活动的常量元素. 族周期ⅠA 11H氢ⅡA ⅢAⅣAⅤAⅥAⅦA2 6C碳xN氮8O氧 3llNa钠12Mg镁 15P磷16S硫17C1氯419K钾20Ca钙-- 试根据上表回答下列问题:(1)氮元素的核电荷数x = .(2)与钠元素化学性质相似的元素为 .(3)氧.氯.硫.磷在化学反应中一般易 电子.趋向达到相对稳定结构.(4)分析上表可发现:每一横行元素从左向右排列所遵循的一条规律是 .
网址:http://m.1010jiajiao.com/timu_id_895578[举报]
我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律.表1列出的是1~18号元素的部分最高正化合价和最低负化合价,请你阅读后回答下列问题:
(1)核电荷数为9的元素名称是
(2)16号元素属于
(3)表中不同元素间最本质的区别是
(4)表中第三横行开头元素和靠近尾部元素的原子结构示意图分别为 和
和 ,它们的单质易发生如图所示的变化.
,它们的单质易发生如图所示的变化.

根据以上的信息,写出这两种元素形成的化合物的化学式为
查看习题详情和答案>>
| 1H +1 |
2He | ||||||
| 3Li +1 |
4Be +2 |
5B +3 |
6C +4,-4 |
7N +5,-3 |
8O -2 |
9F -1 |
10Ne |
| 11Na +1 |
12Mg +2 |
13Al +3 |
14Si +4,-4 |
15P | 16S +6,-2 |
17Cl +7,-1 |
18Ar |
氟
氟
,在化学反应中,该元素的原子容易得
得
(填“得”或“失”)电子;(2)16号元素属于
非金属
非金属
(填“金属”、“非金属”或“稀有气体”)元素,与该元素化学性质相似的另一元素是氧
氧
. 推测该元素的最低负化合价为-2
-2
,最高正化合价的氧化物的化学式为SO3
SO3
.(3)表中不同元素间最本质的区别是
质子数不同
质子数不同
.(4)表中第三横行开头元素和靠近尾部元素的原子结构示意图分别为
 和
和 ,它们的单质易发生如图所示的变化.
,它们的单质易发生如图所示的变化.
根据以上的信息,写出这两种元素形成的化合物的化学式为
NaCl
NaCl
.我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律.下表列出的是1~18号元素的部分最高正化合价和最低负化合价.请你阅读后,回答下列问题:
(1)很多科学家对元素周期表的发现和完善做出了重大贡献,请写出其中一位科学家的名字
(2)表中不同种元素最本质的区别是
A.质子数不同 B.中子数不同
C.相对原子质量不同 D.电子数不同
(3)11号元素属于
(4)16号元素的原子核外电子数为
(5)从化合价角度分析,我们可以发现一些规律.请写出其中的一个:
(6)某元素R与硫酸根形成化合物的化学式为:RSO4,其相对分子质量为152,回答下列问题:
①R的元素符号为
②R在化合物中可以显+3价,则+3价R的氧化物的化学式为
查看习题详情和答案>>
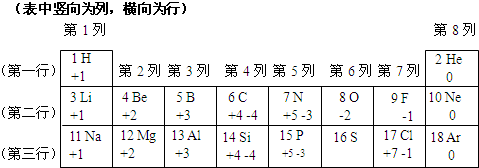
| 1H +1 |
2He 0 | ||||||
| 3Li +1 |
4Be +2 |
5B +3 |
6C +4,-4 |
7N +5,-3 |
8O -2 |
9F -1 |
10Ne 0 |
| 11Na +1 |
12Mg +2 |
13Al +3 |
14Si +4,-4 |
15P +5,-3 |
16S | 17Cl +7,-1 |
18Ar 0 |
门捷列夫
门捷列夫
.(2)表中不同种元素最本质的区别是
A
A
(填序号).A.质子数不同 B.中子数不同
C.相对原子质量不同 D.电子数不同
(3)11号元素属于
金属
金属
元素(填“金属”或“非金属”),它在化学反应中形成的粒子与Ne
Ne
(写元素符号)原子具有相同的核外电子排布.(4)16号元素的原子核外电子数为
16
16
,推测该元素最低负化合价为-2
-2
价,最高正化合价的氧化物的化学式为SO3
SO3
.(5)从化合价角度分析,我们可以发现一些规律.请写出其中的一个:
同一横行(周期)从左到右元素的正化合价逐渐升高
同一横行(周期)从左到右元素的正化合价逐渐升高
.(6)某元素R与硫酸根形成化合物的化学式为:RSO4,其相对分子质量为152,回答下列问题:
①R的元素符号为
Fe
Fe
.②R在化合物中可以显+3价,则+3价R的氧化物的化学式为
Fe2O3
Fe2O3
,+3价R的氧化物中R的质量分数是多少?(写出计算过程)我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律.下表列出的是1~18号元素的部分最高正化合价和最低负化合价,请你阅读后回答下列问题:
(1)推测15号元素的最低负化合价为
(2)表中不同元素间最本质的区别是
(3)表中第三横行开头元素和靠近尾部元素的原子结构示意图分别为 和
和 ,它们的单质易发生如下图所示的变化:
,它们的单质易发生如下图所示的变化:

根据以上的信息,可以得出的结论为
查看习题详情和答案>>
| 1 H +1 |
2 He 0 | ||||||
| 3 Li +1 |
4 Be +2 |
5 B +3 |
6 C +4-4 |
7 N +5-3 |
8 O -2 |
9 F -1 |
10 Ne 0 |
| 11Na +1 |
12 Mg +2 |
13 Al +3 |
14 Si +4-4 |
15 P | 16 S +6-2 |
17 Cl +7-1 |
18 Ar 0 |
-3
-3
,11号和16号元素形成化合物的化学式为Na2S
Na2S
.(2)表中不同元素间最本质的区别是
质子数不同
质子数不同
.(3)表中第三横行开头元素和靠近尾部元素的原子结构示意图分别为
 和
和 ,它们的单质易发生如下图所示的变化:
,它们的单质易发生如下图所示的变化:
根据以上的信息,可以得出的结论为
在化学反应中,金属元素的原子比较容易失去最外层的电子,非金属元素的原子比较容易得到电子,得到最外层电子数目为8的稳定结构
在化学反应中,金属元素的原子比较容易失去最外层的电子,非金属元素的原子比较容易得到电子,得到最外层电子数目为8的稳定结构
.我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律.下表列出的是1~18号元素的部分最高正化合价和最低负化合价.请你阅读后,回答下列问题:
| 1 H +1 | 2 He 0 | ||||||
| 3 Li +1 | 4 Be +2 | 5 B +3 | 6 C +4-4 | 7 N +5-3 | 8 O -2 | 9 F -1 | 10 Ne 0 |
| 11 Na +1 | 12 Mg +2 | 13 Al +3 | 14 Si +4-4 | 15 P +5-3 | 16 S | 17 Cl +7-1 | 18 Ar 0 |
 ;则该元素的________的最外层电子数为________,属于________元素(填“金属”或“非金属”);11号元素在化学反应中形成的粒子与________(写元素符号)原子具有相同的核外电子排布.
;则该元素的________的最外层电子数为________,属于________元素(填“金属”或“非金属”);11号元素在化学反应中形成的粒子与________(写元素符号)原子具有相同的核外电子排布.(2)推测16号元素的最低负化合价为________,最高正化合价的氧化物的化学式为________.
(3)元素周期表是我们学习化学的重要工具,它缊藏着很多规律.从化合价角度分析,我们可以说出其中的一个规律:________. 查看习题详情和答案>>