2006-2007学年度江苏省启东市长江中学初三模拟试卷(八)
本卷可能用到的相对原子质量:
H-1,C-12,O-16, Na-23,Mg-24,S-32,Cu-64,Zn-65
第Ⅰ卷 选择题(共40分)
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1、下列有关环境保护问题的叙述中,错误的是
A、“绿色化学”是指对环境无负面影响的化学
B、“白色化学”主要是指白色粉尘等对环境造成的污染
C、“温室效应”主要是指二氧化碳、甲烷等气体
D、“酸雨”是由大气中含硫和氮的氧化物等导致的
2、通过下列变化,均无法得到单质的是
(1)分解反应 (2)化合反应 (3)置换反应 (4)复分解反应
A、(1)、(2) B、(1)、(2) C、(3)、(4) D、(2)、(4)
3、右图所示装置,有洗气、贮气等多种功能。下列关于该装置用途
的说法中正确的是
 A、用排水法收集H2,瓶内装满水,气体从b管进
A、用排水法收集H2,瓶内装满水,气体从b管进
B、除去CO中的CO2,瓶内装NaOH溶液,气体从b管进
C、测量气体体积,瓶内装满水,气体从b管进a管接量筒
D、用于病人输氧,瓶内装水,a管接供氧钢瓶
4、一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品。外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两包的化学物质反应,此时便可以对食物进行加热,这两包化学物质最合适的选择是
A、浓硫酸与水 B、熟石灰与水 C、生石灰与水 D、氯化钠与水
 5、把分别充满红棕色NO2气体和无色H2的集气瓶,按照右图A、B
5、把分别充满红棕色NO2气体和无色H2的集气瓶,按照右图A、B
两种方式放置,然后把两瓶中间的玻璃片抽走,使两瓶口密合在一
起(不用振荡),可观察到A中两瓶气体的颜色很快趋于一致(两
气体不反应),而B中需很长时间才能达到同样的效果。不能由此
现象直接得出的结论是
A、分子是不断运动的 B、分子间有间隔
C、氢气的密度比二氧化氮的密度小 D、分子由原子构成
6、科学家在宇宙深处已经发现了预言多时的H3+,这个发现对解释宇宙的演化提供了新的参考,H3+表示
A、含有3个质子、2个电子的微粒 B、是一种相对分子质量等于3的单质
C、由3个氢原子构成的分子 D、显酸性的气体
7、科学家用计算机模拟后确认,60个N原子可结合成N60分子。下列关于N60的叙述
中正确的是
A、N60是一种新型的化合物 B、一个N60分子中含有30个N2分子
C、N60和N2的性质完全相同 D、N60和N2混合后形成的是混合物
8、以Zn、CuO、H2SO4为原料,当用两种不同的方法制备相同质量的Cu时,若实验操
作没有失误,则下列有关判断中不符合实际的是
A、两种方法消耗相等质量的Zn B、两种方法消耗不等质量的H2SO4
C、两种方法消耗相等质量的CuO D、两种方法生成不等质量的ZnSO4
9、化合物XY和ZY2中Y的质量分数分别为40%与50%,则化合物XZY4中X的质量分数为
A、20% B、30% C、40% D、50%

 10、甲烷是最简单的有机化合物,实验室用加热固体无水醋酸钠和氢氧化钠混合物的
10、甲烷是最简单的有机化合物,实验室用加热固体无水醋酸钠和氢氧化钠混合物的
方法制得。反应式:CH3COONa+NaOH===Na2CO3+CH4 。该实验可选用的制取装置及收集方法是
A、与加热分解KClO3制氧气的装置相同,用向上排空气法收集
B、与加热分解KClO3制氧气的装置相同,用排水法收集
C、用启普发生器制取,用排水法收集
D、用启普发生器制取,用向下排空气法收集
11、铁匠将烧红的铁器打制后放入冷水后,升腾起一团“白气”,此“白气”是由
A、水汽化形成的 B、铁汽化形成的 C、水蒸气液化形成的 D、铁和水反应生成的
12、下列说法正确的是
A、原子中的核外电子离核越近,能量越高
B、pH=5的碳酸溶液的酸性大于PH=6的硫酸溶液的酸性
C、实验室收集密度比空气小的气体只能用向下排空气集气法
D、除去CO中的较多的CO2,最好的方法是通入澄清石灰水
13、下列叙述正确的是
A、某物质在空气中燃烧后的产物中有CO2和H2O,则此物质一定是CH4
B、某物质在空气中燃烧后的产物只有CO2,则此物质一定是CO
C、某物质在空气中燃烧后的产物中有CO2和H2O,则此物质一定是碳、氢元素组成的化合物
D、酒精含有碳、氢、氧三种元素,它在空气中燃烧后的产物是CO2和H2O,但只能判断它一定有碳、氢两种元素
14、下图形象地表示某反应前后反应物与生成物分子及其数目的变化,其中
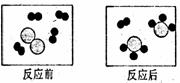
 分别表示A、
B、C三种不同的分子。该反应的化学方程式中A、B、C前的化学计量数之比为
分别表示A、
B、C三种不同的分子。该反应的化学方程式中A、B、C前的化学计量数之比为
A、4:1:3 B、3:l:2
C、4:l:2 D、3:1:3
15、由SO2、SO3组成的混合气体,经分析混合气体中硫元素的质量分数为48%,则混合
气体中的SO2、SO3质量比为
A、6:5
B、4:
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分)
16、要把盐酸、碳酸钠、硫酸、氢氧化钠和硝酸钾五种透明溶液鉴别开来,下面的实验
方案中你认为所加的试剂和先后顺序合理的是
A、BaCl2溶液、稀HNO3、石蕊试液 B、酚酞试液、AgNO3溶液、稀HNO3
C、稀HNO3、石蕊试液、BaCl2溶液 D、AgNO3溶液、石蕊试液、稀HNO3
17、某食品防腐剂是一种酸的钠盐,其中各元素的质量分数为:C:58.33%,H:3.47%,
O:22.2%,Na:16.0%。该物质的相对分子质量至少为
A、144
B、
18、20世纪初,一些化学家提出了酸碱质子理论。这种理论认为,凡能放出质子(H+)
的分子或离子都是酸;凡能结合质子的分子或离子都是碱。根据这一理论,下列物质中不属于碱的是
A、HNO3 B、HCO3- C、NH4+ D、SO42-
19、下列说法正确的是
A 、NaOH和MgO的混合物中氧的质量分数为40%,NaOH和MgO的质量比为任意值
B、一定量的氯化钠溶液恒温蒸发
C、用H2完全还原一定质量的CuO,参加反应的H2与通入的H2质量一定相等
D、将98%的浓H2SO4稀释成49%的稀H2SO4,加入水的质量与浓硫酸质量一定相等
 20、下列制取物质的设计中,不可能实现的是
20、下列制取物质的设计中,不可能实现的是



 A、CaCO3
A、CaCO3

 B、Cu
CuO
CuSO4溶液 Cu(OH)2沉淀
B、Cu
CuO
CuSO4溶液 Cu(OH)2沉淀


 C、KMnO4 O2
SO3
H2SO4
C、KMnO4 O2
SO3
H2SO4


 D、Ba(OH)2
BaCl2
BaCO3沉淀
D、Ba(OH)2
BaCl2
BaCO3沉淀
第Ⅱ卷 非选择题(共60分)
三、填空题(每空1分,化学方程式每条2分,共31分)
21、请运用你在初中学过的化学知识和技能,解决下列生活中的实际问题(在每个问题
对应的横线上写出你选用的物质或方法):
(1)暖水瓶中出现水垢(主要成分是CaCO3),可加入__________除法;
(2)除去冰箱中的异味,可在冰箱中放入____________;
(3)为了使湿的衣服干得更快,可采取的方法是___________________________;
(4)自行车被雨淋湿后,为防止生锈,你应做的是__________________________;
(5)课外活动小组的同学用学校的自来水浇灌校园内的花草时,要将一硬质塑料管与胶
皮管相连接,塑料管不易插入胶皮管,可采取的办法是_____ ____________
_____________________________________________________.
22、鱼是人们非常喜爱并经常食用的食品。剖鱼时若不小心弄破了鱼胆,胆汁沾在鱼
肉上,就会使鱼肉带有苦味而影响人的食欲.但汁中具有苦味的物质主要是胆汁酸
(一种酸),沾在鱼肉上的胆汁酸很难用水洗掉.
(1)根据上面的描述,请你写出胆汁酸的一种物理性质______________________.
(2)为除去沾在鱼肉上的胆汁酸,消除鱼肉的苦味,可用厨房中常用的一种物质的溶
液浸泡,这种物质是____________.若用HR表示胆汁酸的化学式,则浸泡过程中发
生反应的化学方程式为_________________________________________.
23、今年初春,我国某些地区出现了高致病性禽流感,为防止疫情蔓延,必须迅速进
行隔离,并对受禽流感病毒污染的禽舍、工具等进行消毒。资料显示:禽流感病毒
在高温、碱性环境(如氢氧化钠溶液)、高锰酸钾或次氯酸钠等消毒剂中生存能力较
差。请回答:
(1)次氯酸钠(NaClO)属于_________(填“氧化物”、“酸”、“碱”或“盐”),
其中氯元素的化合价为__________价。
(2)用加热高锰酸钾熏蒸消毒禽舍,写出发生反应的化学方程式_____ ___________
(3)以下对受污染工具的消毒方法可行的是_________ (填序号),
A、用NaOH溶液浸泡 B、用水冲洗即可 C、用NaClO溶液浸泡
 24、请认真观察右图,写出图中对话所涉及到的
24、请认真观察右图,写出图中对话所涉及到的
其中两点化学知识。如:铁易导热。
(1)_______________________________。
(2)_______________________________。
氧气约占0.13%,岩层中合有较丰富的镁资源。
请用化学方程式解释下列设想:
(1)检验取回的火星大气中含有二氧化碳
__________________________________
(2)利用点燃的镁能在二氧化碳中燃烧生成氧化镁和碳,来解决人类在火星上生存的燃料问题_______________________________________________________。
26、南通滨江临海,有着丰富的海洋资源。从海洋中可提取许多
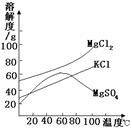 重要物质。请你参与下列问题的讨论:
重要物质。请你参与下列问题的讨论:
(1)我市某盐场测得:①海水中含NaCl约为3.5%;②
在海边打深井,井水中含NaCl约为8%。晒盐最好用
(填序号)作原料。
(2)关于晒盐原理的说法正确的是____
A、利用阳光和风力,使水分蒸发,析出盐
B、日光照晒后,氯化钠的溶解度变小
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)
等物质。参照右图各物质的溶解度曲线,从卤水中提取KCl晶体采用下列方法:①将卤水加热到
27、(1)在CO和CO2的混合气体中,CO和CO2的分子个数比为4:1,则混合气体中碳元
素与氧元素的质量比为______。
(2)当碳与氧气的质量比大于________时燃烧时不可能全部转化为二氧化碳。
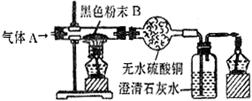 28、下图所示的实验中,通入的气体A
28、下图所示的实验中,通入的气体A
是氢气和一氧化碳中的一种或两种,
黑色粉末B 是氧化铜和木炭粉中的
一种或两种.实验中观察到的现象是:
黑色粉末变红色,无水硫酸铜变蓝色,澄清石灰水变浑浊.由此判断:气体A与黑色粉末B可能的组合有哪几种?(每种组合中A和B的成分均要求用化学式表示)_______
_____________ ________
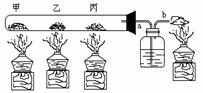 29、将适量氧化铜固体、少量氯酸钾粉未、足量炭粉分别放入如图所示大试管中,对甲、乙、丙三个部位进行加热,每一个部位只放一种固体,乙处粉未呈黑色,随着反应的进行,要能得到单质铜。
29、将适量氧化铜固体、少量氯酸钾粉未、足量炭粉分别放入如图所示大试管中,对甲、乙、丙三个部位进行加热,每一个部位只放一种固体,乙处粉未呈黑色,随着反应的进行,要能得到单质铜。
(1)甲、乙、丙三部位各放固体是:
甲、______ ____乙、___ ____丙、__ _____
四、实验题(每空1分,共19分)
30、在实验室中,利用右图装置可以制取并收集多种气体(必要时可以加热)。
(1) 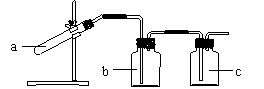 李明同学想利用该装置制取干燥的O2,应对
李明同学想利用该装置制取干燥的O2,应对
装置作何改进? 。
a中发生反应的化学方程式为
_____________________ ;
b中盛放的试剂是 。
(2)李明同学还想利用上述实验装置制取H2和CO2,请你对他的方案给予评价:
制取的气体
A中盛放的
试剂
B中盛放的试剂
评 价
(回答是否可行;若不可行,说出理由)
H2
Zn、稀H2SO4
浓H2SO4
CO2
大理石、稀盐酸
浓H2SO4
31、已知催化剂是能改变化学反应速率,而本身的质量和化学性质在反应前后都没有改变的物质。某班级化学小组同学在学习了催化剂的知识后,他们想探究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和后续操作:
①称量两份氯酸钾各
入A试管中。
②将A和B试管同时在相同的条件下正确加热,经检验A试管40秒后开始产生氧气,B试管2分钟后开始产生氧气。
③停止加热、冷却,将A试管反应后的混合物加水充分溶解,认真过滤,得滤出物,
洗涤并干燥。
④观察滤出物的状态和颜色。
⑤称量滤出物的质量为
⑥将滤出物和炭粉混合,在密闭容器中高温加热,将反应产生的气体通入澄清石灰水
中,观察到澄清石灰水变浑浊。
请回答:
(1)若省略操作⑤,能否达到实验目的,为什么? 。
(2)若用下图实验装置(每个装置都备有多套)和相应操作替换第⑥步实验,也可以
达到实验目的。请把下图中仪器连接成一套符合实验目的的实验装置,这套实验装置
的接口连接顺序是(填写各接口的字母): 接 ; 接 ; 接 ; 接 。(气
流的方向从左往右)在已连接好的装置中,乙装置的作用是 __ _________

(3)经上述探究过程后得出的结论是:氧化铜 作氯酸钾制氧气时的催化剂。
(填“能”或“不能”)
32、某校化学课外活动小组的同学为确定一包黑色粉末的成分,按图装置进行实验,其
中X是制取H2的装置。
(1)常温下,铝片与氢氧化钠溶液反应也能生成H2,若利用此反应制取氢气,X应选择_______装置(填字母代号)。
(2)将(1)中所制H2通入玻璃管前,需先通过D装置,D装置的作用__________________
___________________________。
(3)加热玻璃管一段时间后,管内黑色粉末完全变为红色固体,且烧杯内澄清石灰水变浑浊,则黑色粉末的成分为____________________
(4)写出A装置中玻璃管内发生的化学方程式为____________________

33、某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究碳酸氢钠的化学性质
(1)取样品溶于适量的水中,测得溶液的PH大于7。
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳。该反
应的化学方程为 。
(3)向小苏打的溶液中加入澄清石灰水,生成了白色沉淀。
 (4)同学们通过查阅资料,在老师的指导下采用了右图所示装置对小苏打和纯碱做了
(4)同学们通过查阅资料,在老师的指导下采用了右图所示装置对小苏打和纯碱做了
对比实验。实验中小试管内沾有无水硫酸铜粉末的棉花球
变成蓝色,a烧杯中石灰水无明显现象,b烧杯
中石灰水了现白色浑浊。试回答:
① 在实验结束时,操作上要注意的问题是:_____
② 由实验(4)可以得出的结论是 。
请归纳出小苏打的化学性质(至少三点)
________________ _________ 。
________________________ 。
_________________________________________________________________。
五、计算题(本题包括2小题,共10分)
34、空气中含有的少量臭氧(O3)可以起到消毒、杀菌作用,但臭氧过量对人体有害。我国的环境空气质量标准对空气中臭氧的最高浓度(单位体积的空气中所含臭氧的质量)限值如下表所示:
浓度限值(mg/m3)
一级标准0.12
二级标准0.16
三级标准0.20
臭氧与KI溶液反应,生成一种可使带火星的木条复燃的气体,反应后的溶液能使酚
酞试液变红,也能使蘸有淀粉溶液的滤纸条变蓝。为测定某地空气中臭氧的含量,将
硫酸钠(Na2S2O3)溶液(含Na2S2O3的质量为47.4mg)恰好完全反应:
(2Na2S2O3+I2=Na2S4O6+2NaI ).
(1)O3与KI溶液反应的化学方程式是__________________________________;
(2)通过计算确定该地空气中臭氧的浓度级别。
35、侯氏制碱法制得的纯碱中通常含有少量的氯化钠。现有含氯化钠杂质的纯碱样品
22.
求:(1)原样品中的碳酸钠的质量。
(2)最后所得滤液中溶质的质量分数。