2007-2008学年高一第一次月考
化学试题
命题人:吴惠子 吴育军 审题人:张喜娟
试卷说明:
1.本试卷分Ⅰ卷和Ⅱ卷,Ⅰ卷答案涂在答题卡上,Ⅱ卷答案写在答题纸上。
2.试卷满分110分,答题时间90分钟。
可能用到的相对原子质量:H 1 O 16 N 14 K 39 Cl 35.5 Mn 55 Cu 64
一、选择题(每小题只有一个正确选项,1-14题每题2分,15-24每题3分)
1、下列反应一定属于氧化还原反应的是
A、复分解反应 B、化合反应
C、置换反应 D、分解反应
2、下列叙述正确的是
A、氧化还原反应一定不是离子反应
B、在氧化还原反应中,氧化剂和还原剂可以是同一种反应物
C、还原剂在氧化还原反应中发生还原反应
D、氧化反应和还原反应不一定同时存在于一个反应中
3、下列反应不属于氧化还原反应的是
A.
B. 
C.
D.CO2+CaCO3+H2O=Ca(HCO3)2
4、下列变化过程,属于还原反应的是
A、HCl →MgCl2 B、Na →Na+ C、CO→ CO2 D、Fe3+→ Fe
5、加入适当的氧化剂才能实现的反应是( )
A.H2O2→H2O B.MnO2→Mn2+ C.SO2→SO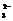 D.Fe→Fe2O3
D.Fe→Fe2O3
6、反应 中,氧化产物是
中,氧化产物是
A.K2MnO4 B.MnO2 C.O2 D.KMnO4
7、火药的爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是
A.N B.C C.N和S D.N和C
8、下列反应中,水只作氧化剂的是
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.  D.Na2O+H2O=2NaOH
D.Na2O+H2O=2NaOH
9、有关强、弱电解质叙述正确的是
A、所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
B、强电解质溶液导电能力一定强,弱电解质溶液导电能力一定弱
C、强酸、强碱,大部分盐类是强电解质,弱酸,弱碱和水是弱电解质
D、NaOH溶液导电的原因是因为它在电流作用下,电离出自由移动的Na+和OH-
10、是强电解质而且又能导电的是
A、液态氯化氢 B、熔融烧碱 C、氯化钠溶液 D、氨水
11、能用离子方程式H++OH-=H2O来表示的是
A、盐酸和氢氧化钠溶液 B、氢氧化镁和盐酸
C、醋酸和氢氧化钾 D、醋酸和氨水
12、溶液中能大量共存的是
A.H+
C. Cu2+ NO3- Cl- Na+ D. Ba2+ Cl- CO32- Na+
13、下列反应既属于氧化还原反应,又属于离子反应的是
A. Zn+稀H2SO4 B. NaCl+AgNO
14、根据反应式:① 2Fe3+ + 2I- = 2Fe2+ + I2 ② Br2 + 2Fe2+ = 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是
A、Br2 、Fe3+ 、I2 B、I- 、Fe2+ 、Br- C、Br- 、I- 、Fe2+ D、Fe2+ 、I- 、Br-
15、下列叙述中正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
16、在反应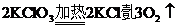 中,生成1个O2时转移的电子数目是
中,生成1个O2时转移的电子数目是
A、4 B、6 C、12 D、5
17、NO2溶于水时的反应是:3NO2+H2O=2HNO3+NO。在该反应中氧化剂和还原剂的分子个数之比是
A、3:1 B、2:1 C、1:2 D、1:3
18、在反应8NH3 + 3Cl2 = 6NH4Cl + N2中,若有28克N2生成,则发生氧化反应的物质的质量是
A、34g B、35.5g C、51g D、136g
19、硫酸铵在强热条件下分解,生成氨,二氧化硫,氮气和水,反应生成的氧化产物和还原产物的分子个数之比是
A、1:3 B、2:3 C、1:1 D、4:3
20、下列离子方程式,书写正确的是
A、盐酸与碳酸钡反应
CO32-+2H+==CO2↑+H2O
B、铁与稀盐酸反应
2Fe+6H+==2Fe3++3H2↑
C、硝酸银溶液中加入铜粉
Ag++Cu==Cu2++Ag↓
D、硫酸铜溶液中滴加氢氧化钡溶液
Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓
21、在强酸性的无色溶液中可大量共存的一组离子是
A、Na+,Cl-,OH-,Al3+ B、NH4+,Mg2+,NO3-,Cl-
C、K+,Cu2+,Cl-,Mg2+ D、Fe2+,SO42-,CO32-,Na+
22、下列离子反应不能发生的是
A.NaOH+KCl=NaCl+KOH
B.AgNO3+HCl=AgCl↓+HNO3
C.Na2CO3+Ca(OH)2=NaOH+CaCO3↓
D.NH4NO3+NaOH=NaNO3+NH3?H2O
23、在xR++yH++O2= xR3++nH2O的离子反应中,系数x的值为
A. 2n B.4 C.y/4 D.2
24、单质X和Y相互反应生成 ,现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④Y2-是还原产物;⑤Y2-具有还原性;⑥X2+具有氧化性;⑦Y的氧化性比X2+的氧化性强。其中正确的是
,现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④Y2-是还原产物;⑤Y2-具有还原性;⑥X2+具有氧化性;⑦Y的氧化性比X2+的氧化性强。其中正确的是
A.①②③④ B.①④⑤⑥⑦ C.②③④ D.①③④⑤
二、填空题
25、(14分)用双线桥法表示下列反应中的电子转移的方向和数目,并完成填空。
2KMnO4+16HCl=2KCl+2MnCl2 + 5Cl2↑+8H2O
氧化剂 ,还原剂 ,
氧化剂与还原剂的质量比是:
26、(16分)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是 。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是 ,有关的离子反应式为 。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有 。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号) 。
A.Cl- B.NO3- C.CO32- D.
27、(12分)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ba2+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)
现将溶液两两混合,记录现象如下:
A+B→白色沉淀
B+D→白色沉淀
C+D→蓝色沉淀
则A、B、C、D的化学式分别是 、 、 、 。
三、计算题
28、(14分)将一定量的CuO与H2共热,一段时间后称得粉末的质量减少了3.2克,求生成了多少克Cu,有多少克H2被氧化?
 附加题(10分)
附加题(10分)
利用图1-13的装置来做下面的实验:
在烧杯里盛半杯Ba(OH)2溶液,然后用滴定管向容器里滴入稀硫酸。随着H2SO4的滴入,电灯就渐渐变暗,滴至一定量时,电灯完全熄灭。为什么(用反应方程式说明)?如果继续滴入H2SO4,电灯又会逐渐亮起来,为什么?在滴入H2SO4的同时,能观察到溶液里有什么现象发生?如果用HCl溶液代替H2SO4,能观察到同样的现象吗?为什么?
化学答案
1
2
3
4
5
6
C
B
D
D
D
C
7
8
9
10
11
12
C
B
C
B
A
C
13
14
15
16
17
18
B
B
D
A
C
A
19
20
21
22
23
24
A
D
B
A
D
B
25、氧化剂:KMnO4 还原剂:HCl 质量比:316∶511