高三年级月考化学试题
第Ⅰ卷
一、选择题(每题3分,共48分)
1.下列关于碱金属的叙述正确的是( )
A.碱金属与氧气反应生成的化合物均是碱性氧化物
B.第IA族元素都是碱金属元素
C.碱金属在自然界都以化合态存在
D.随着碱金属核电荷数增加,单质的熔、沸点逐渐升高
2.下列叙述正确的是( )
A.直径介于1nm~10nm之间的微粒称为胶体
B.胶体粒子很小,可以透过半透膜
C.利用丁达尔效应可以区别溶液与胶体
D.电泳现象可证明胶体属于电解质溶液
3.下列说法中正确的是( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是易溶化合物,弱电解质一定是难溶化合物
C.属于共价化合物的电解质在熔化状态下一般不导电
D.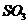 溶于水后溶液导电性很强,所以
溶于水后溶液导电性很强,所以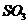 是强电解质
是强电解质
4.A、B两种元素的质子数之和为21,A原子核外电子数比B原子核外电子数少5个,下列叙述中不正确的是( )
A.A单质在固态时属于分子晶体
B.B单质在固态时属金属晶体,能与某些金属氧化物反应
C.B的最高价氧化物能与酸反应,但不能与碱反应
D.A、B可构成一种阴离子,这种阴离子与硝酸反应可转化成B的阳离子
5.把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图。经过一段时间后,首先观察到溶液变红的区域是( )
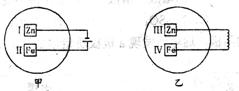
A.Ⅰ和Ⅲ 附近 B.Ⅰ和Ⅳ 附近
C.Ⅱ和Ⅲ 附近 D.Ⅰ和Ⅳ 附近
6.根据下列反应判断有关物质氧化性由强到弱的顺序是( )
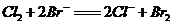
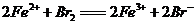
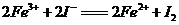
A.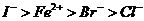 B.
B.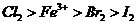
C.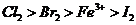 D.
D.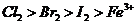
7.在无色酸性溶液中,下列各组离子能够大量共存的是( )
A.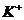 、
、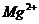 、
、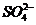 、
、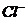 B.
B.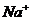 、
、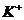 、
、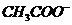 、
、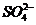
C.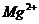 、
、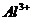 、
、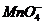 、
、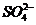 D.
D.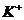 、
、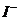 、
、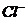 、
、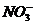
8.下列离子方程式中正确的是( )
A. 氢氧化铁溶于氢碘酸中: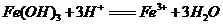
B.向沸水中滴加少量饱和氯化铁溶液: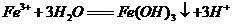
C.等体积、等物质的量浓度的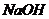 溶液和
溶液和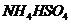 溶液混合:
溶液混合:
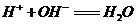
D.醋酸洗涤铜器表面的碱式碳酸铜:
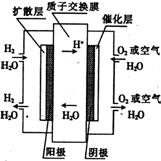
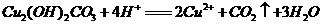
9.为体现“绿色奥运”、“科技奥运”,2008年北京奥运会上将出现中国自己生产的电动燃料汽车,作为马位松领跑车和拍摄车。该车装有“绿色心脏”――质子交换膜燃料电池,其工作原理如右图所示。下列叙述中正确的是( )
A.通入氧气的电极发生氧化反应
B.通入氢气的电极是正极
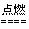 C.正极的电极反应式为:
C.正极的电极反应式为: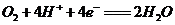
D.总反应的化学方程式为: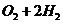
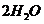
10.已知1 mol白磷变成红磷放出73.56 kJ的热量,下列两个反应:
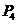 (白磷,s)+
(白磷,s)+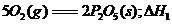
4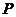 (红磷,s)+
(红磷,s)+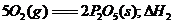
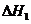 和
和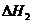 的关系正确的是( )
的关系正确的是( )
A.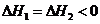 B.
B.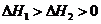
C.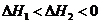 D.
D.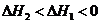
11.用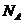 表示阿伏加德罗常数的数值,下列说法中一定正确的是( )
表示阿伏加德罗常数的数值,下列说法中一定正确的是( )
A.1 mol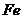 与足量的碘单质反应,转移的电子数为3
与足量的碘单质反应,转移的电子数为3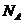
B.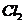 中所含的分子数约为
中所含的分子数约为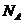
C.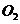 中所含的电子数为8
中所含的电子数为8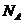
D.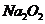 与
与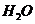 反应生成1 mol
反应生成1 mol 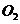 共转移电子4
共转移电子4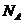
12.下列说法中不正确的是( )
①钠和铜都能在氯气中燃烧产生白烟 ②氢气在氯气中燃烧火焰为淡蓝色 ③液氯就是氯气的水溶液,它能使干燥的有色布色褪色 ④久置的氯水,因氯气几乎完全挥发了,剩下的就是水
A.只有① B.①和② C.①和④ D.①②③④
13.将等质量的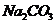 和
和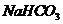 分别加入足量的
分别加入足量的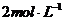 的盐酸中,生成
的盐酸中,生成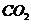 的体积(相同状况)与时间的关系正确的是( )
的体积(相同状况)与时间的关系正确的是( )
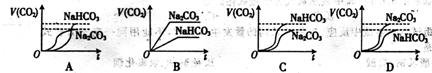
14.某课堂研究小组,为了确定某无色溶液的离子组成,进行了如下实验:
①测得溶液显强碱性
②取少量的原溶液,在其中加入稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体
③取少量的原溶液,在其中滴加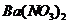 溶液,产生白色沉淀
溶液,产生白色沉淀
④在②反应后的溶液中滴加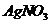 溶液,产生白色沉淀
溶液,产生白色沉淀
则以下推测中,正确的是( )
A.一定有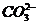 离子存在 B.可能有
离子存在 B.可能有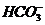 离子
离子
C.一定有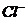 离子存在 D.不能确定
离子存在 D.不能确定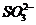 离子是否存在
离子是否存在
15.有 某气体,可能含有
某气体,可能含有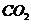 、
、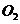 、
、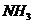 等气体,将其通过浓
等气体,将其通过浓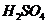 没有发现体积变化,通过足量的
没有发现体积变化,通过足量的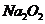 后,体积变为
后,体积变为 ,则该气体的组成是(
)
,则该气体的组成是(
)
A.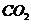 为
为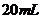 ,
,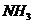 为
为 B.
B.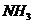 为
为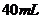 ,
,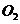 为
为
C.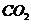 为
为 ,
,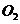 为
为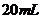 D.
D.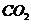 为
为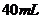 ,
,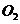 为
为
16.将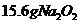 和
和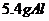 同时放入一定量的水中,充分反应后得到
同时放入一定量的水中,充分反应后得到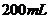 溶液,再向该溶液中缓慢通入标准状况下的
溶液,再向该溶液中缓慢通入标准状况下的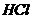 气体
气体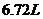 ,若反应过程中溶液的体积保持不变,则( )
,若反应过程中溶液的体积保持不变,则( )
A.反应过程中得到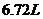 气体(标准状况)
气体(标准状况)
B.最终得到的溶液中: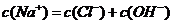
C.最终得到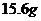 沉淀
沉淀
D.最终得到的溶液中: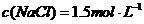
第Ⅱ卷
二、填空题(共52分)
17.按下列各要求写出化学方程式,并用单线桥法标出电子转移的方向和数目。
(1) 一种阴离子氧化一种单质
(2)一种单质氧化一种阴离子
(3)一种阴离子氧化另一种阴离子
(4)一种阳离子氧化一种阴离子
18.按下列要求写出离子方程式
(1)强酸制弱酸
(2)强碱制弱碱
(3)金属单质与水反应制强碱
(4)非金属单质与水反应
19.(8分)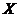 、
、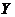 、
、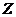 、
、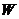 是按原子序数依次增大的短周期元素。
是按原子序数依次增大的短周期元素。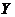 、
、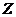 原子最外层电子数分别是其电子层数的2、3倍,
原子最外层电子数分别是其电子层数的2、3倍,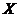 分别与
分别与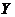 、
、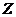 可形成含18个电子的共价分子
可形成含18个电子的共价分子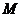 、
、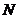 ,
,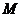 分子所含原子个数是
分子所含原子个数是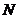 的2倍,
的2倍,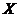 与
与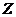 形成的阴离子
形成的阴离子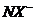 与
与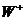 电子数相同。
电子数相同。
(1)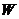 的元素符号为
的元素符号为
(2)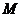 的名称为
的名称为
(3)由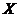 、
、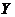 、
、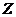 、
、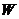 四种元素组成的化合物(任选一种)与
四种元素组成的化合物(任选一种)与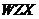 反应的化学方程式为
反应的化学方程式为
(4)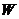 的单质在氧气中充分燃烧得
的单质在氧气中充分燃烧得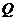 ,将
,将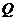 投入到硫酸亚铁溶液中,若
投入到硫酸亚铁溶液中,若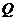 与硫酸亚铁按物质的量之比为1∶1反应,则该反应的离子方程式为
与硫酸亚铁按物质的量之比为1∶1反应,则该反应的离子方程式为
20.(10分)已知: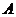 、
、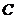 焰色反应为紫色;
焰色反应为紫色;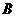 、
、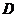 、
、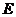 是常见单质且
是常见单质且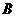 、
、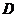 为气体;
为气体;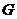 为
为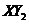 (
(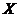 、
、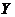 分别为组成单质
分别为组成单质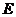 、
、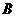 的元素)型离子化合物。试根据下图回答下列问题。
的元素)型离子化合物。试根据下图回答下列问题。
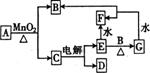
(1)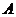 的化学式为
的化学式为
(2)写出用惰性电极电解熔融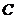 的阳极反应式
的阳极反应式
(3)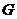 与水的反应类似于
与水的反应类似于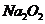 与水的反应,则
与水的反应,则 与水反应的化学方程式为
与水反应的化学方程式为
(4) 的晶体结构类似于氯化钠,
的晶体结构类似于氯化钠, 的晶体中阴、阳离子个数比为
的晶体中阴、阳离子个数比为
(5)若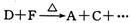 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
21.(8分)某河道两旁有甲、乙两厂,它们排放的工业废水中共含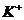 、
、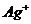 、
、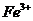 、
、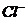 、
、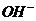 、
、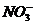 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是
。
乙厂的废水中含有另外三种离子。如果加一定量 (填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属 (填写元素符号)
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀,经过滤后的废水主要含 ,可用来 浇灌农田。
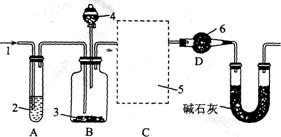
22.纯碱中常含有少量的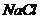 等杂质,可利用如下图所示仪器装置来测定纯碱中
等杂质,可利用如下图所示仪器装置来测定纯碱中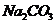 的质量分数。
的质量分数。
图中:1、空气;2、某溶液;3、纯碱;4、稀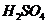 ;6、碱石灰。其实验步骤是:
;6、碱石灰。其实验步骤是:
a.按上图所示仪器组装好实验装置,并检查其气密性;
b.准确称量盛有碱石灰的干燥管D的质量(设为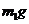 );
);
c.准确称量一定量的纯碱(设为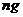 ),并将其放进广口瓶内;
),并将其放进广口瓶内;
d.从分液漏斗中缓缓滴入一定量稀硫酸并从“
e.准确称量干燥管D的总质量(设为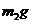 )。
)。
根据上述实验,回答下列问题:
(1)该实验进行至操作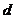 要缓缓鼓入空气,鼓入空气的作用是
要缓缓鼓入空气,鼓入空气的作用是
装置A中盛装的液体“
(2)在上图中空白格内画了装置C及写出所有试剂。装置C盛放的试剂“5”是 。说明装置C的作用是 。如果撤去装置C,则会导致实验测定结果 (填“偏大”、“偏小”、“不变”)
(3)根据此实验,计算纯碱中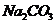 的质量分数的数学式为
(用
的质量分数的数学式为
(用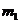 、
、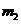 、
、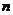 表示)
表示)
(4)装置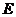 的作用是
的作用是
高三年级月考化学答题纸
第Ⅱ卷
二、填空题(共52分)
17.(8分)
(1)
(2)
(3)
(4)
18.(8分)
(1)
(2)
(3)
(4)
19.(8分)
(1)
(2)
(3)
(4)
20.(10分)
(1)
(2)
(3)
(4)
(5)
21.(8分)
。
22.(10分)
(1)
(2)
(3) (2分)
(4)