2009届湖南雅礼中学高三第四次月考化学试题
考生注意:本试题分 I卷、II卷,21道小题,满分100分,时量90分钟
可能用到的相对原子质量:Na-23 Mg-24 Al-27 N-14 Fe-56 Cl-35.5 Br-80 H-1
O
长沙市雅礼中学高三化学备课组组稿
命题人:吴建新 审题人:林枭
第Ⅰ卷
一选择题(每小题只有一个选项符合题意,请将该选项的代号填入答卷中表格的相应位置,每小题3分,共48分)
1.利用新技术能将不锈钢加工成为柔软的金属丝,它和棉纤维一起编织成为防辐射的劳防服装,这是利用了金属的
A.耐腐蚀性 B.还原性 C.热传导性 D.延展性
【解析】考查金属的特性,金属光泽、导电性、延展性、导热性。
【答案】D
2.下列关于氯化铁溶液与氢氧化铁胶体的叙述中不正确的是
A.分散质微粒都可透过滤纸
B. 两种分散系都有丁达尔现象
C. 加热、蒸干、灼烧后,二者都能得到氧化铁
D. 氢氧化铁胶粒带正电荷,但胶体呈电中性
【解析】考查胶体的相关概念和性质,理解FeCl3溶液在加热过程中水解促进导致得水解完全的产物。
【答案】B
3. 下列实验操作正确的是
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水
③配置氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口附近
⑧滴定管装液前,应该检查是否漏水
A.①④ B.②④⑤ C.①③ D.②③④⑥⑦⑧
【解析】浓硫酸具有强氧化性会将橡胶氧化,pH试纸使用时不能预先润湿,否则相当于稀释,带来测定误差。
【答案】D
4.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下
(1)CuSO4 + Na2CO3
主要:Cu2+ + CO32-+ H2O → Cu(OH)2↓+CO2↑ 次要:Cu2+ + CO32-→CuCO3↓
(2)CuSO4 + Na2S
主要:Cu2+ + S2-→ CuS↓ 次要:Cu2+ + S2-+ 2H2O→Cu(OH)2↓+ H2S↑
据此,下列几种物质溶解度大小比较中,正确的是
A.Cu(OH)2 > CuCO3 > CuS B.CuCO3 > Cu(OH)2 > CuS
C.CuS > CuCO3 > Cu(OH)2 D.CuS > Cu(OH)2 > CuCO3
【解析】溶液中复分解反应要满足复分解反应的条件,当有多种可能时,优先生成更难溶的沉淀。
【答案】B
5.制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是
A.③②④①⑦ B.③②⑤⑥④ C. ③②④⑤⑦ D.②④①⑦⑤
【解析】Fe(OH)2的制备方法是教材要求的演示实验,实验操作的关键是要防止氧化带来的干扰。加热、加铁粉、加植物油、加入试剂的滴管的使用都是实验成功的关键。
【答案】A
6.下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+,Cl―,Na+,H2PO4―,PO43―,SO42―
②PH=11的溶液中:CO32―,Na+,AlO2―,NO3―,S2―,SO32―
③水电离的H+浓度C(H+)=10―12mol?L―1的溶液中:Cl―,HCO3―,NO3―,NH4+,S2O32―
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl―,K+,SO42―
⑤使石蕊变红的溶液中:Fe3+, NO3―,Na+,SO42―
⑥酸性溶液中:Fe2+,Al3+,NO3―,I―,Cl―,S2―
A.①②③④⑤⑥ B .①②⑥ C. ②④⑤ D .①②⑤
【解析】①中H2PO4―,PO43―在溶液中会生成HPO4-而不能共存。③中水电离的H+浓度C(H+)=10―12mol?L―1的溶液可能呈酸性或碱性,而 HCO3―不可能共存;⑥中酸性溶液中NO3―具有强氧化性,能将 Fe2+, I―,S2― 等氧化而不能共存。
【答案】C
7.在25℃时,有80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末a g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
A.溶液中c(Ba2+)将增大 B.溶液的pH将增大
C.溶液中Ba2+总数将减少 D.溶液中c(OH-)减少
【解析】理解饱和溶液的概念,析出晶体后的溶液依然是饱和溶液
 【答案】C
【答案】C
8.在固定容积的密闭容器中,可逆反应2X + Y(g) Z(s) 已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是
A. 若X为非气态,则正反应为吸热反应
B. 正反应为放热反应,X为气态
C. 在平衡混合物中加入少量Z,则平衡向左移动
D.压强变化对该平衡没有影响
【解析】气体的密度取决于容器内气体的质量与容器的体积,从密度的变化可以看出气体的质量怎样变化;从而判断出平衡的移动方向及反应的吸、放热情况;至于X的状态由题干中混合气体的提法可以得出结论;由于Z是纯固体,浓度看成是定值,增减它的量平衡不受影响。
【答案】B
9.将4g铝、铁合金粉末溶于足量盐酸中,加入过量氢氧化钠溶液,过滤后在滤液中通入足量二氧化碳,再将沉淀滤出,经洗涤、干燥、灼烧后得到固体粉末的质量仍为4 g,原合金中铁的质量分数最接近
A、30% B、47% C、53% D、70%
【解析】本题的关键在于了解物质变化的过程,最后的固体物质的成分为Al2O3,由于质量不变,则相当于氧元素的质量分数就是原混合物中铁的质量分数。
 【答案】B
【答案】B
10. 某温度下,在一容积可变的容器中,反应 2A(g) + B(g) 2C(g) 达到平衡时,A、B 和C的物质的量分别为 4 mol、2 mol和 4 mol 。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A 均减半 B 均加倍 C 均增加 1 mol D 均减少 1 mol
【解析】由于反应是在恒温、恒压的可变活塞式容器中进行,故对平衡量进行加倍或减半的操作,相当于等效平衡,平衡状态不变,平衡不移动。
但都增加1mol相当于在各增加1mol、0.5mol、1mol的基础上再增加0.5molB,前者增加属于等效平衡,从而导致平衡正向移动;都减少1mol,相当于在各减少1mol、0.5mol、1mol的基础上再减少0.5molB,前者属于等效平衡,从而平衡应该逆向移动。
【答案】C
 11.将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一
11.将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一
定温度下发生反应:H2(g)+ I2(g)  2HI(g); △H<0 ,并达
2HI(g); △H<0 ,并达
到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示,
若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变
的条件可能是
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
【解析】由于是等体积反应,改变体系的压强平衡状态不受影响,,而催化剂只改变速率,不影响平衡的移动。
【答案】C
 12. 如图所示,不同温度和压强下,在固定容积的密闭容器中对可逆反应:
12. 如图所示,不同温度和压强下,在固定容积的密闭容器中对可逆反应:
4L(g) 2M(g)+N(g); △H>0
平衡状态的影响( ),图中Y轴可以表示的涵义是:
),图中Y轴可以表示的涵义是:

A. 体系中物质L的百分含量
B. 体系中总的气体分子数目
C. 气体混合物的平均相对分子质量
D. 气体混合物的密度
【答案】C
13. 下列各选项中所述的两个量,前者一定大于后者的是
A.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
B.pH=10的NaOH和Na2CO3溶液中,水的电离程度
C. 物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH 的物质的量浓度
的物质的量浓度
D.相同温度下,10mL 0.1mol/L的醋酸与100mL 0.01mol/L的醋酸中H+的物质的量
【解析】物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液比较,由于(NH4)2CO3溶液中存在双水解,水解程度大些,水解掉的NH 多,故NH
多,故NH 物质的量浓度是(NH4)2SO4溶液中的大。
物质的量浓度是(NH4)2SO4溶液中的大。
【答案】C
14. 某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是
A.H2Y的电离方程式为:H2Y+2H2O 2H3O++ Y2-
2H3O++ Y2-
B.在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.HY-的水解方程式为HY-+H2O H3O++Y2-
H3O++Y2-
D.在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+)
【解析】由某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度可以判断H2Y属于二元弱酸,其电离应该逐步进行。HY-的电离程度小于HY-的水解程度,但其水解的程度很弱,主要以HY-的型体存在,且溶液呈碱性。
【答案】D
15. 将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
【解析】尽管都是一元酸,但PH相等时两酸溶液的物质的量浓度不一定相等,因为酸可能有强弱的不同;酸越弱,酸的物质的量浓度越大,中和等量的NaOH溶液消耗的酸的体积越小。
【答案】A
16. 向100 mL FeBr2 溶液中通入标准状况下的 Cl2 3.36 L 全部被还原,测得溶液中
c(Br-) = c(Cl-) ,则原 FeBr2 溶液的物质的量浓度是
A 0.75 mol/L B 1.5 mol/L C 2 mol/L D 3 mol/L
【解析】由于还原性的顺序是Fe2+>Br-,故通入氯气后首先和溶液中的Fe2+反应,可以利用得失电子守恒列出FeBr2的物质的量n的关系式为:(3.36/22.4)×2=n+[2n-(3.36/22.4)×2]
可以得出n=0.2mol
【答案】C
第Ⅱ卷
二、填空题(本题包含17、18、19三道小题,共22分)
17.(8分)在T℃时,水的离子积为KW=10―12,在此温度下,将pH=a的盐酸溶液Va L与pH=b的Ba(OH)2溶液Vb L混合:
(1)由数据可以判断T 25(填 “大于” 、“小于”、 “等于”);理由是: 。
(2)若所得混合液为中性,且a+b=10,则Va┱Vb为 ;
(3)若所得混合液的pH=10,且a=2,b=12则Va┱Vb为 。
【解析】水的电离过程是个吸热过程,在常温时水的离子积为KW=10―14,比常温时的离子积要大,说明温度比常温时的高;由于温度不同,应该在新的条件进行有关溶液pH的相关计算。
如果溶液呈中性,则有10-a.Va=10(b-12).VB ;如果所得混合溶液的pH=10,则说明混合后溶液呈碱性,碱过量,则有10(b-12).Vb-10-a.Va=(Va+Vb).10(10-12)
【答案】(1)大于;水的电离是吸热过程,温度升高,水的电离平衡右移,导致离子积增大 (或其它合理表述也可,每空2分)
(2)1┱100(2分)
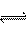 (3)99┱2 (2分)
(3)99┱2 (2分)
18.(8分) 反应aA(g) +bB(g) cC(g)+d D(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
(1)平衡时A与B的转化率之比是 。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d ) (填“>”“=”“<”或“没关系”)。
(3)设定a=2 ,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是 (填容器序号)。
【解析】由于转化率等于转化量与起始量的比值,转化量之比与起始量之比均满足方程式的系数比,故平衡时A、B的转化率之比为1:1;同等程度的增大反应物的起始量对于等体积反应属于等效平衡,如果要使反应物的转化率都增加,则平衡需正向移动,正向为体积缩小的方向。
【答案】(1)1∶1 (2分) (2)>(2分)(3)丁 (2分) 甲>乙>丙>丁(2分)
19.(6分)海水是取之不尽的化工原料资源库,从海水中可提取各种化工原料。下图是工业上对海水的几项综合利用的示意图:
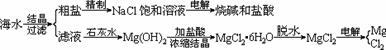
(1)由MgCl2?6H2O晶体脱水制无水MgCl2时,MgCl2?6H2O晶体在 气氛中加热脱水,该气体的作用是
(2)电解无水MgCl2所得的镁蒸气可以在下列 气体中冷却(选填代号)。
A H2 B N2 C CO2 D O2
【解析】在MgCl2.6H2O加热脱除结晶水的过程要考虑防止水解,同时电解后得到的高温Mg蒸气会和N2、CO2、O2等反应
 【答案】
【答案】
(1)HCl 抑制水解平衡MgCl2+H2O Mg(OH)Cl+HCl ,防止MgCl2水解(每空2分)
(2)A(2分)
三、实验题(本题包含第20小题,共16分)
20.(16分)有一工业烧碱(含氯化钠),现要求采用学过的定量实验的方法测定此工业烧碱中氢氧化钠的质量分数(假设各步实验中试样的损失忽略不计),请完成如下实验报告。
实验报告
(一) 实验目的:工业烧碱中氢氧化钠的质量分数测定
(二) 实验原理:(写出有关离子反应方程式):_____________________________,
(三) 实验试剂:工业烧碱、标准浓度的盐酸、甲基橙。
(四) 实验仪器:铁架台(成套)、天平、烧杯、锥形瓶、移液管、胶头滴管、100ml量筒、 ________、_______。
(五) 按实验顺序填写实验步骤: (中和滴定法)
______、溶解、移液管量取一定体积的待测液于洁净的锥形瓶中、__________、用标准盐酸滴定至终点。
当滴定至溶液由______色变为_____色,且半分钟不腿色时停止滴定。在相同条件下重复二次。
(六)数据处理及问题讨论:
1、若要测定样品中氢氧化钠的质量分数,实验中至少需要测定那些实验数据?_______________________________________。
2、取a克样品,配置100mL溶液,取20mL待测液,用C mol/L的标准盐酸滴定至终点,消耗盐酸VmL。试写出样品中氢氧化钠的质量分数表达式为: 。
【解析】考查中和滴定的实验操作方法,计算方法和数据记录、处理等的综合实验能力;由题干提示的溶解及中和滴定的实验步骤不难找到所缺的实验仪器。在数据处理的第2问所提供的有关数据不难找到第一问所需测定的实验数据。
【答案】(二)H++OH--=H2O (2分);
(四)玻璃棒、酸式滴定管(每空1分,共2分,不写清楚“酸式”不给分);
(五) 称量、 滴加几滴甲基橙 (每空2分,共4分); 黄、橙 (每空1分,共2分)、
(六)1、样品的质量、消耗标准盐酸的体积数、配制待测液的总体积、每次实验移液管移取待测液的体积 (每空1分,共4分)
2、 (20CV/a)%或0.2CV/a ( 2分)
四、推断题(本题包含第21小题,共14分)
21.(14分)下列各单质与化合物之间的关系如下图,单质及化合物的组成元素皆为短
周期元素,请回答:
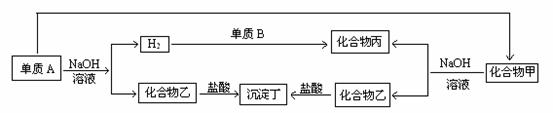 (1)若沉淀丁不溶于过量的盐酸, 甲为 ;乙为 。
(1)若沉淀丁不溶于过量的盐酸, 甲为 ;乙为 。
若沉淀丁能溶于过量的盐酸,丁为 。
(2)单质B一定是__________。写出丙的电子式: 。
(3)写出有关反应方程式
① 沉淀丁不溶于过量盐酸时,写出A+NaOH的反应:
② 沉淀丁能溶于过量盐酸时,写出化合物乙与过量盐酸反应的方程式:
【解析】在中学知识范围内能与NaOH溶液反应产生H2的单质可能有Si Al Be Zn等,
但从常见、熟悉的短周期元素来看,应该不难找到答案。
【答案】(每空2分,共14分)
(1)甲为:SiO2 乙为:Na2SiO3
丁为:Al(OH)3 (写名称也可)
(2)O2 ;丙的电子式:H┱O┱H
(3)Si +2NaOH +H2O == Na2SiO3 +2H2↑
(4)AlO2-+4H+= Al3++2H2O (由于没有注明,写离子方程式也可)