网址:http://m.1010jiajiao.com/timu_id_549752[举报]
有一工业烧碱(含氯化钠),现要求采用学过的定量实验的方法测定此工业烧碱中氢氧化钠的质量分数(假设各步实验中试样的损失忽略不计),请完成如下实验报告。
实验报告
(一) 实验目的:工业烧碱中氢氧化钠的质量分数测定
(二) 实验原理:(写出有关离子反应方程式):_____________________________,
(三) 实验试剂:工业烧碱、标准浓度的盐酸、甲基橙。
(四) 实验仪器:铁架台(成套)、天平、烧杯、锥形瓶、移液管、胶头滴管、100ml量筒、 ________、_______。
(五) 按实验顺序填写实验步骤: (中和滴定法)
______、溶解、移液管量取一定体积的待测液于洁净的锥形瓶中、__________、用标准盐酸滴定至终点。
当滴定至溶液由______色变为_____色,且半分钟不腿色时停止滴定。在相同条件下重复二次。
(六)数据处理及问题讨论:
1、若要测定样品中氢氧化钠的质量分数,实验中至少需要测定那些实验数据?_______________________________________。
2、取a克样品,配置100mL溶液,取20mL待测液,用C mol/L的标准盐酸滴定至终点,消耗盐酸VmL。试写出样品中氢氧化钠的质量分数表达式为: 。
查看习题详情和答案>>叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
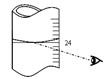
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。