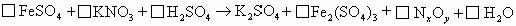高考热点专题测试卷:专题一 化学基本概念
说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.
第Ⅰ卷(共83分)
一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.
1.下列一些媒体中出现的说法,你认为科学的是( )
A.本饮料纯属天然,绝对不含化学物质
B.新粉刷过石灰浆的房间释放出 ,严禁入内
,严禁入内
C.水是取之不尽用之不竭的 D.易燃易爆的车间严禁穿化纤类衣服
2.化学反应前后肯定没有变化的是( )
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④ B.①③⑤ C.①③④ D.①②③④
3.下列变化一定属于化学变化的是( )
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色
A.①②③④ B.③④⑤⑦ C.①③⑤⑦ D.①③④⑦
4.下列各组物质,前者是混合物,后者是纯净物的是( )
A.胆矾 玻璃 B.汽油 液氯 C.石油 盐酸 D.干冰 铝热剂
5.下列说法中,正确的是( )
A.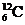 和
和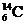 原子的中子数相等
B.纯水在
原子的中子数相等
B.纯水在
C.钢中碳的质量分数比生铁中的要大 D.次氯酸是一种强氧化剂,是一种弱酸
二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.
6.下列说法中正确的是(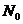 表示阿伏加德罗常数)( )
表示阿伏加德罗常数)( )
A.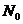
B.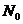
C.1 mol甲烷的质量与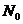 个甲烷分子的质量之和相等
个甲烷分子的质量之和相等
D.在标准状况下,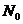
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
7.某温度时,化合物甲的饱和溶液m g中含溶质a g,化合物乙的饱和溶液m g中含溶质b g.则在此温度时,甲、乙两化合物的溶解度之比是( )
A.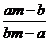 B.
B.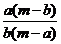 C.
C.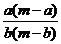 D.
D.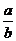
8.单质X都能从盐的溶液中置换出单质Y,由此可知( )
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y可能是金属,也可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
9.下列说法中正确的是( )
A.碱性氧化物一定是金属氧化物 B.金属氧化物一定是碱性氧化物
C.酸性氧化物一定是非金属氧化物 D.非金属氧化物一定是酸性氧化物
10.某物质经分析知其中仅含一种元素,此物质是( )
A.一定是一种单质 B.一定是一种纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
11.密度为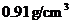 的氨水,其溶质的质量分数为0.25,该氨水用等体积的水稀释后,所得氨水的质量分数为( )
的氨水,其溶质的质量分数为0.25,该氨水用等体积的水稀释后,所得氨水的质量分数为( )
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
12.某金属最高价氟化物的分子量为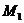 ,其最高价的硫酸盐的式量为
,其最高价的硫酸盐的式量为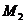 ,若此元素的最高正价为n,则n与
,若此元素的最高正价为n,则n与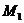 、
、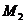 的关系可能是( )
的关系可能是( )
A.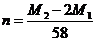 B.
B.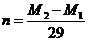 C.
C.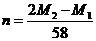 D.
D.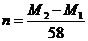
13.向某溶液加入过量的HCl析出白色沉淀,过滤后向滤液中加入过量的氨水,使溶液呈碱性,又有白色沉淀析出,再经过滤,向滤液中加入纯碱溶液,仍有白色沉淀析出,则原溶液中含有的阳离子是( )
A.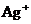 ,
,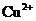 ,
,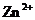 B.
B.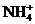 ,
,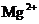 ,
,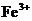
C.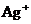 ,
,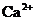 ,
,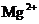 D.
D.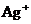 ,
,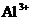 ,
,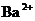
三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.
14.将标准状况下的a LHCl(气)溶于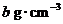 ,则该盐酸的物质的量的浓度是( )
,则该盐酸的物质的量的浓度是( )
A.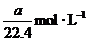 B.
B.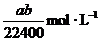
C.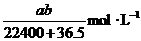 D.
D.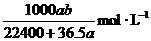
15.用初中电解水的实验装置电解水和重水(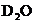 )组成的混合液,通电一段时间后,在两极共收集到
)组成的混合液,通电一段时间后,在两极共收集到
A.3∶1 B.1∶3 C.2∶3 D.4∶1
16.在
A.(100+S)g B.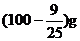 D.
D.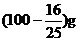
17.某些金属卤化物可跟其卤素反应,如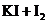
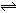
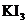 下列推断错误的是( )
下列推断错误的是( )
C.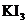 溶液可用于检验淀粉的存在 D.配制碘水时,加入KI可增大
溶液可用于检验淀粉的存在 D.配制碘水时,加入KI可增大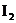 的溶解度
的溶解度
18.当H、O、C、N四种元素的相对原子质量均取整数时,下列说法正确的是( )
A.a-氨基酸的相对分子质量均为偶数 B.硝基化合物的相对分子质量均为奇数
C.烃及烃的含氧衍生物的相对分子质量均为偶数 D.酚、醛、羧酸、酯的相对分子质量均为偶数
19.将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发,且蒸发过程中无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍.设溶质的式量为M,则蒸发后所得溶液的物质的量浓度为( )
20.羟胺(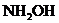 )是一种还原剂.现用
)是一种还原剂.现用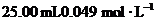 的羟胺的酸性溶液跟足量的
的羟胺的酸性溶液跟足量的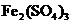 溶液在煮沸条件下反应,生成
溶液在煮沸条件下反应,生成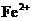 离子恰好与
离子恰好与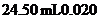
 的酸性
的酸性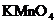 溶液完全作用生成
溶液完全作用生成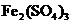 ,
,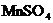 等物质,则上述反应中羟胺的氧化产物是( )
等物质,则上述反应中羟胺的氧化产物是( )
A.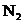 B.
B.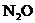 C.NO D.
C.NO D.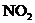
21.在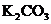 样品中含
样品中含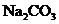 、
、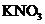 、
、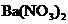 中的一或二种杂质.将
中的一或二种杂质.将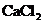 溶液,可得
溶液,可得
A.肯定有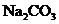 ,没有
,没有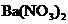 B.肯定有
B.肯定有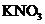 ,没有
,没有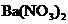 ,可能还有
,可能还有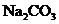
C.肯定没有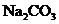 ,
,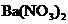 D.无法判断何种为肯定或否定的杂质
D.无法判断何种为肯定或否定的杂质
22.下列各组离子能在指定溶液中共存的是( )
①无色溶液中: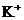 、
、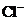 、
、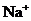 、
、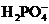 、
、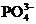 、
、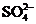
②使pH试纸变深蓝的溶液中: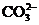 、
、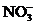 、
、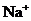 、
、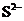 、
、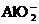 、
、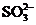
③水电离的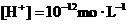 的溶液中:
的溶液中: 、
、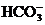 、
、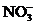 、
、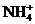 、
、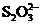
④加入Mg能放出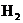 的溶液中:
的溶液中: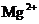 、
、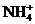 、
、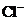 、
、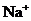 、
、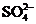
⑤使甲基橙变红的溶液中: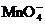 、
、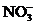 、
、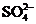 、
、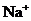 、
、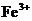
⑥pH=0的溶液中: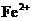 、
、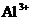 、
、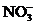 、
、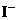 、
、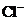 、
、
A.①③ B.②④⑤ C.①②⑤ D.③⑥
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
答题卡
题号
1
2
3
4
5
6
7
8
9
10
11
分值
3分
3分
3分
3分
3分
4分
4分
4分
4分
4分
4分
选项
题号
12
13
14
15
16
17
18
19
20
21
22
分值
4分
4分
4分
4分
4分
4分
4分
4分
4分
4分
4分
选项
第Ⅱ卷(共67分)
四、本题包括2小题,共17分
23.(8分)(1)试指出下列仪器的名称
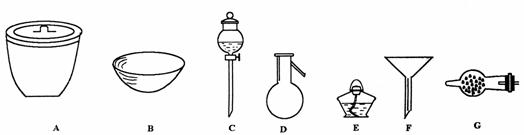
(2)进行下面的实验,必须用到上述何种仪器
①欲干燥 需使用仪器________________;
需使用仪器________________;
②欲分离互不相溶的两种液态物质,须使用________________;
③欲分离液态混合物中沸点不同的组分,须使用________________;
④欲分离浮于液体中的固体物质,须使用________________________________;
⑤欲用醋酸钠晶体制无水醋酸钠,以备甲烷制取实验,须使用________.
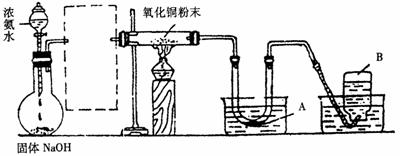
24.实验室进行某项实验的装置如下图.
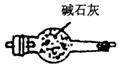
Ⅱ
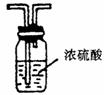
实验现象记录如下:w.w.w.k.s.5.u.c.o.m
①黑色的氧化铜粉末变为光亮的红色;
②生成物A能使无水硫酸铜粉末变蓝色;
③镁带能在另一种生成物B中燃烧生成一种固态物质C,C与A起反应生成碱性物质D和一种能使湿润的红色石蕊试纸变蓝的气体E.
回答以下问题:
(1)虚线方框内应选的干燥装置是________(填标号)
(2)A的分子式为________;B的分子式为________.
(3)在制氨的装置中,固体NaOH的作用是________________________.
(4)写出下列反应的化学方程式:
①氨与灼热氧化铜的反应________________.
②C与A的反应________________.
五、本题包括2小题,共16分
25.(8分)铜、铁、锌等质量合成的合金W g,加入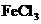 和盐酸的混合液中,充分反应后:
和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有________,还可能有________.
(2)若剩余固体为W/
(3)若剩余固体为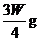 ,则溶液中的阳离子一定有________,一定没有________.
,则溶液中的阳离子一定有________,一定没有________.
26.(8分)(1)在热的稀硫酸溶液中溶解了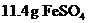 .当加入
.当加入
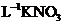 溶液后,使其中的
溶液后,使其中的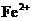 全部转化成
全部转化成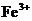 ,
,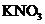 也反应完全,并有
也反应完全,并有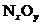 氮氧化物气体逸出.
氮氧化物气体逸出.
(2)油画所用颜料含有某种白色的铅化合物,置于空气中,天长日久就会生成黑色PbS,从而使油画的色彩变暗,若用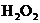 来“清洗”,则可将PbS转变为白色的
来“清洗”,则可将PbS转变为白色的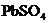 而使油画“复原”.请填空:
而使油画“复原”.请填空:
①上述“清洗”反应的化学方程式为________________________________.
②若有0.1 mol的PbS参加反应,则在此反应中发生转移的电子为________mol.
六、本题包括2小题,共17分
27.(9分)(1)向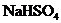 溶液中,逐滴加入
溶液中,逐滴加入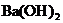 溶液至中性,写出发生反应的离子方程式:
溶液至中性,写出发生反应的离子方程式:
________________________________________.
在以上中性溶液中,继续滴加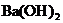 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
________________________________________.
(2)向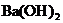 溶液中,逐滴加入
溶液中,逐滴加入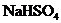 溶液至恰好不再生成沉淀为止,写出反应的离子方程式:
溶液至恰好不再生成沉淀为止,写出反应的离子方程式:
________________________________________.
在以上溶液中,继续滴加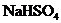 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
(3)向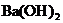 溶液中,逐滴加入明矾溶液至溶液中
溶液中,逐滴加入明矾溶液至溶液中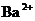 恰好完全沉淀,其反应的离子方程式为:
恰好完全沉淀,其反应的离子方程式为:
________________________________________.
在上述溶液中,继续滴加明矾溶液,请写出此步反应的离子方程式: _______________________________.
28.(8分)(1)将一定量的NaOH和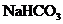 混合物X,放在密闭容器中加热,充分反应后生成
混合物X,放在密闭容器中加热,充分反应后生成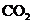 气体
气体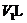 (
(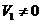 ).将反应后的固体残渣Y与过量的盐酸反应又生成
).将反应后的固体残渣Y与过量的盐酸反应又生成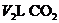 气体,气体体积均在标准状态下测定.
气体,气体体积均在标准状态下测定.
①Y的化学式是_________.
A.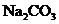 NaOH B.
NaOH B.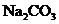
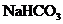 C.
C.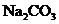 D.NaOH
D.NaOH
②X中NaOH、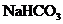 物质的量之比为:_________.
物质的量之比为:_________.
(2)常温下A和B两种气体组成混合物(A的式量大于B的式量),经分析混合气体中只含碳和氢两种元素,而且不论A和B以何种比例混合,碳和氢的质量比总小于12∶4,由此可确定A为_________;B为_________;其理由是______________________________
______,若上述混合气体中碳和氢质量比为6∶5,则在混合气体中A和B的物质的量之比是_________.A在混合气体中的体积分数为_________.
七、本题包括2小题,共17分
29.(9分)(1)邻苯二甲酸氢钾(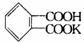 分子量204.2)可以用来标定NaOH溶液的浓度,反应如下:
分子量204.2)可以用来标定NaOH溶液的浓度,反应如下: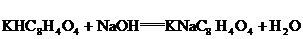 .准确称取
.准确称取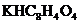 晶体
晶体
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
(2)测定食醋的总酸度.食醋中除醋酸(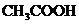 )外,还含有少量其它有机酸.食醋的总酸度以每1000 mL食醋中含醋酸(其他酸也折算作醋酸)的质量(g)表示,通常写作
)外,还含有少量其它有机酸.食醋的总酸度以每1000 mL食醋中含醋酸(其他酸也折算作醋酸)的质量(g)表示,通常写作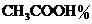 .用移液管移取市售食醋50.00
mL,置于250 mL容量瓶中,用水稀释至250mL.再从中移取25.00 mL,用上小题已知浓度的NaOH溶液滴定,消耗碱液体积为V(mL),写出
.用移液管移取市售食醋50.00
mL,置于250 mL容量瓶中,用水稀释至250mL.再从中移取25.00 mL,用上小题已知浓度的NaOH溶液滴定,消耗碱液体积为V(mL),写出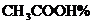 的计算式.
的计算式.
(3)已知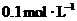 邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合溶液的pH等于7,则碱与酸的浓度比值(x)为_________(选填下列选项编号)
邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合溶液的pH等于7,则碱与酸的浓度比值(x)为_________(选填下列选项编号)
A.x>2 B.x=2 C.2>x>1
D.x=1 E.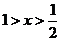 F.
F.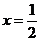
30.(8分)现有一份CuO和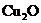 混合物,用
混合物,用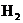 还原法测定其中CuO的质量x(g).实验中可以测定如下数据:W为混合物的质量(g);
还原法测定其中CuO的质量x(g).实验中可以测定如下数据:W为混合物的质量(g);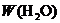 为生成
为生成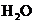 的质量(g);W(Cu)为生成Cu的质量(g);
的质量(g);W(Cu)为生成Cu的质量(g);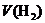 为消耗的
为消耗的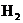 在标准状况下的体积(L).(已知摩尔质量:Cu为
在标准状况下的体积(L).(已知摩尔质量:Cu为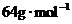 ;CuO为
;CuO为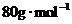 ;
;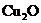 为
为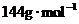 ;
;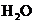 为
为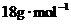 )
)
(1)为了计算x,至少需要测定上述四个数据中的_________个,这几个数据的组合共有_________种,请将这些组合一一填入下表空格中.
说明:①选用W、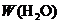 、W(Cu)、
、W(Cu)、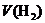 表示,不必列出具体计算式.
表示,不必列出具体计算式.
②每个空格中填一种组合,有几种组合就填几种,不必填满.
(2)从上述组合中选写一个含W的求x的计算式.
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
1.D 2.C 3.C 4.B 5.D 6.CD 7.B 8.AC 9.A 10.D 11.C 12.AB
13.D 14.D 15.A 16.B 17.B 18.C 19.D 20.B 21.B 22.B
23.(1)A.坩埚 B.蒸发皿 C.分液漏斗 D.蒸馏烧瓶 E.漏斗 F.酒精灯 G.干燥管
(2)①G ②C ③D、F ④E ⑤B、F
24.(1)I (2) ;
; (3)溶解放热,并提供大量的
(3)溶解放热,并提供大量的
(4)①
②
25.分解与解答:(1)电子氧化性 ,而Cu、Fe、Zn全部液解,故一定有
,而Cu、Fe、Zn全部液解,故一定有 、
、 、
、 ,可能还有
,可能还有 、
、
(2)根据氧化还原反应进行的次序规律,因还原性Zn>Fe>Cu,若剩余固体W/ 与Cu反应,
与Cu反应, 与Cu不反应,故一定有
与Cu不反应,故一定有 、
、 ,可能还有
,可能还有 ,一定没有
,一定没有 、
、
(3)剩余固体为Cu、Fe、Zn,只有部分Zn溶解,加之 、
、 均要与Fe反应,故一定有
均要与Fe反应,故一定有 、
、 ,一定没有
,一定没有 、
、 、
、
26.(1)①x=1,y=1;②6、2、4=1、3、2、4;
③
(2) ;Mn
;Mn
27.(1) ;
;
(2) ;
;
(3) ;
;

28.(1)①C ②
(2) ;
; ;在
;在 分子中,C、H质量比为12∶4,在
分子中,C、H质量比为12∶4,在 混入任何比例的
混入任何比例的 都将使C、H质量比小于12∶4;1∶3 25%
都将使C、H质量比小于12∶4;1∶3 25%
(2) 或0.1500 V
%
或0.1500 V
%
(3)C
30.(1)2;5
W、 ;W、
;W、 ;W、
;W、 ;
; 、
、 ;
; 、
、
(2) 或
或 或
或
 www.ks5u.com
www.ks5u.com
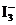 溶液中存在如下平衡:
溶液中存在如下平衡:
 B.在
B.在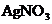 溶液,会析出
溶液,会析出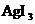 沉淀
沉淀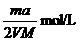
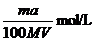 C.
C.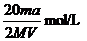 D.
D.