网址:http://m.1010jiajiao.com/timu_id_499989[举报]
1.D 2.C 3.C 4.B 5.D 6.CD 7.B 8.AC 9.A 10.D 11.C 12.AB
13.D 14.D 15.A 16.B 17.B 18.C 19.D 20.B 21.B 22.B
23.(1)A.坩埚 B.蒸发皿 C.分液漏斗 D.蒸馏烧瓶 E.漏斗 F.酒精灯 G.干燥管
(2)①G ②C ③D、F ④E ⑤B、F
24.(1)I (2) ;
; (3)溶解放热,并提供大量的
(3)溶解放热,并提供大量的
(4)①
②
25.分解与解答:(1)电子氧化性 ,而Cu、Fe、Zn全部液解,故一定有
,而Cu、Fe、Zn全部液解,故一定有 、
、 、
、 ,可能还有
,可能还有 、
、
(2)根据氧化还原反应进行的次序规律,因还原性Zn>Fe>Cu,若剩余固体W/ 与Cu反应,
与Cu反应, 与Cu不反应,故一定有
与Cu不反应,故一定有 、
、 ,可能还有
,可能还有 ,一定没有
,一定没有 、
、
(3)剩余固体为Cu、Fe、Zn,只有部分Zn溶解,加之 、
、 均要与Fe反应,故一定有
均要与Fe反应,故一定有 、
、 ,一定没有
,一定没有 、
、 、
、
26.(1)①x=1,y=1;②6、2、4=1、3、2、4;
③
(2) ;Mn
;Mn
27.(1) ;
;
(2) ;
;
(3) ;
;

28.(1)①C ②
(2) ;
; ;在
;在 分子中,C、H质量比为12∶4,在
分子中,C、H质量比为12∶4,在 混入任何比例的
混入任何比例的 都将使C、H质量比小于12∶4;1∶3 25%
都将使C、H质量比小于12∶4;1∶3 25%
(2) 或0.1500 V
%
或0.1500 V
%
(3)C
30.(1)2;5
W、 ;W、
;W、 ;W、
;W、 ;
; 、
、 ;
; 、
、
(2) 或
或 或
或
 www.ks5u.com
www.ks5u.com
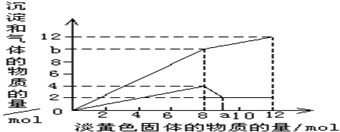 现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+.当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.试回答下列问题:
现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+.当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.试回答下列问题:(1)最终的白色沉淀的成分是(填化学式)
(2)试确定该溶液中可能含有以上离子中的哪些离子并计算其相应的物质的量,完成下表
| 可能含有的离子 (填离子符号) |
Mg2+ Mg2+ |
Al3+ Al3+ |
NH4+ NH4+ |
无 无 |
无 无 |
| 相应的物质的量 | 2mol 2mol |
2mol 2mol |
6mol 6mol |
无 无 |
无 无 |
(4)图中b点的气体组成成分是(填化学式)
下列离子在指定溶液中一定能大量共存的是( )
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl-、S2-
②在PH=11的溶液中:Na+、[Al(OH)4]-、NO3-、S2-、SO32-
③由水电离的c(H+)=10-12 mol·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+、F-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
A.②④ B.①②④ C. ①③④ D.①②
查看习题详情和答案>>下列离子在指定溶液中一定能大量共存的是 ( )
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO![]() 、Cl-、S2-
、Cl-、S2-
②在pH=11的溶液中:Na+、[Al(OH)4]-、NO![]() 、S2-、SO
、S2-、SO![]()
③由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、HCO![]() 、NO
、NO![]() 、NH
、NH![]() 、F-
、F-
④加入Mg能放出H2的溶液中:Mg2+、NH![]() 、Cl-、K+、SO
、Cl-、K+、SO![]()
A.②④ B.①②④ C.①③④ D.①②
查看习题详情和答案>>下列离子在指定溶液中一定能大量共存的是 ( )
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO![]() 、Cl-、S2-
、Cl-、S2-
②在pH=11的溶液中:Na+、[Al(OH)4]-、NO![]() 、S2-、SO
、S2-、SO![]()
③由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、HCO![]() 、NO
、NO![]() 、NH
、NH![]() 、F-
、F-
④加入Mg能放出H2的溶液中:Mg2+、NH![]() 、Cl-、K+、SO
、Cl-、K+、SO![]()
A.②④ B.①②④ C.①③④ D.①②
查看习题详情和答案>>(一)探究铝合金的抗腐蚀性能
①向一只小烧杯里加入20mL0.5mol/LCuSO4溶液,把一小块铝合金浸入溶液中,1~2分钟后将铝片取出,观察铝片表面的现象
②取1只试管,加入10mL2mol/LNaOH溶液,将一块铝片放入NaOH溶液里,片刻取出后,用蒸馏水冲洗后浸入CuSO4溶液里.1~2分钟后将铝片取出,观察铝片表面的现象
实验①铝片没有变化,实验②铝片表面的现象是
发生此现象的原因是
(二)测定铝合金中的铝的百分含量
①取该样品a克,将样品溶于足量的稀盐酸中,过滤;
②在滤液中加入过量的氢氧化钠溶液,过滤;
③往第②步的滤液中通入足量的CO2,过滤,将沉淀用蒸馏水洗涤后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为b克.
回答下列问题:
(1)在第①步操作中溶解所使用的玻璃仪器为玻璃棒、
(2)在第②步操作中氢氧化钠溶液需要过量的原因是
(3)第③步灼烧过程中可在下列哪种仪器中进行
A.烧杯 B.试管 C.坩埚 D.蒸发皿
(4)第③步灼烧后得到的固体是
(5)合金中铝的质量分数是
| 54b |
| 102a |
| 54b |
| 102a |


