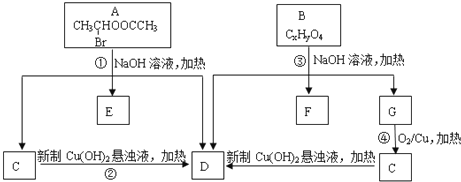
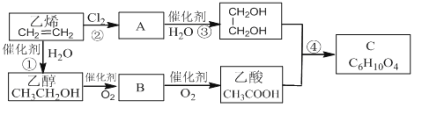
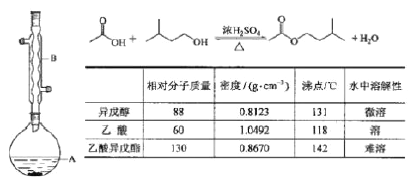
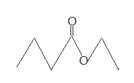
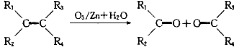题目内容
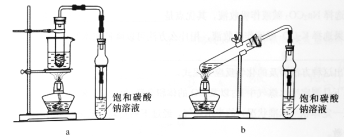
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验可用a装置来制备。
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
【答案】(1)增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。(合理即给分)
浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。
浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率。
(2)中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解
(3)振荡、静置
(4)原料损失较大、易发生副反应;乙醚;蒸馏
【解析】
试题分析:(1)由于是可逆反应,因此加入过量的乙醇增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。由于浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,因此实际用量多于此量;由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率,所以浓硫酸用量又不能过多。
故答案为;增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率;浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解。
故答案为:中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解;
(3)乙酸乙酯不溶于水,因此反应后,将试管中收集到的产物倒入分液漏斗中,振荡、静置,然后分液即可。
故答案为:振荡;静置;
(4)根据b装置可知由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易
发生副反应,由于乙醇溶液发生分子间脱水生成乙醚,所以b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,乙醚和乙酸乙酯的沸点相差大,则分离乙酸乙酯与该杂质的方法是蒸馏。
故答案为:原料损失较大;易发生副反应;易发生副反应;乙醚;蒸馏。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案