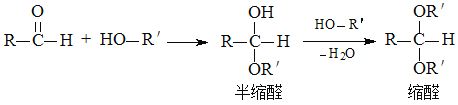
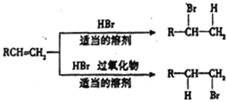
题目内容
【题目】正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4 ℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去):
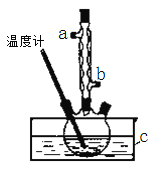
实验过程如下:在容积为100 mL的三颈烧瓶中加入5 mL浓硫酸、14.8 g正丁醇和几粒沸石,迅速升温至135 ℃,一段时间后,收集到粗产品,精制得到正丁醚。回答下列问题:
(1)制取正丁醚的化学方程式为____________。
(2)合成粗产品时,液体试剂加入顺序是____________。
(3)实验中冷凝水应从____________口进入(填“a”或“b”)。
(4)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为____________。
(5)得到的正丁醚粗产品依次用8 mL50%的硫酸、10 mL水萃取、洗涤、分液。该步骤中需要的玻璃仪器是烧杯、玻璃棒、____________。
(6)将分离出的有机层用无水氯化钙干燥,过滤后再进行____________(填操作名称)精制得到正丁醚。
【答案】(1)2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3 +H2O;(2)先加正丁醇,后加浓硫酸;(3)b ;(4)该液体沸点高于135 ℃ ;(5)分液漏斗;(6)蒸馏。
CH3CH2CH2CH2OCH2CH2CH2CH3 +H2O;(2)先加正丁醇,后加浓硫酸;(3)b ;(4)该液体沸点高于135 ℃ ;(5)分液漏斗;(6)蒸馏。
【解析】
试题分析:(1)根据信息,正丁醇在浓硫酸迅速加热到135℃时,得到正丁醚,其反应方程式为:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3 +H2O;(2)浓硫酸的密度大于正丁醇,因此正丁醇中加入浓硫酸,因此先加正丁醇,再加浓硫酸;(3)冷凝管作用使正丁醇冷却,回流到三颈烧瓶中,减少原料的损失,冷凝水的进水方向是下口,即b;(4)因为生成正丁醚的温度是135℃,因此具有物理性质是高于135℃;(5)萃取、分液用到的仪器是分液漏斗、烧杯,洗涤用到的仪器为玻璃棒,因此缺少的是分液漏斗;(6)进行蒸馏。
CH3CH2CH2CH2OCH2CH2CH2CH3 +H2O;(2)浓硫酸的密度大于正丁醇,因此正丁醇中加入浓硫酸,因此先加正丁醇,再加浓硫酸;(3)冷凝管作用使正丁醇冷却,回流到三颈烧瓶中,减少原料的损失,冷凝水的进水方向是下口,即b;(4)因为生成正丁醚的温度是135℃,因此具有物理性质是高于135℃;(5)萃取、分液用到的仪器是分液漏斗、烧杯,洗涤用到的仪器为玻璃棒,因此缺少的是分液漏斗;(6)进行蒸馏。

 阅读快车系列答案
阅读快车系列答案