题目内容
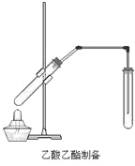
【题目】已知酸与醇反应可制得酯。谬化学小组以苯甲酸(![]() )原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
![]()
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2 g苯甲酸和20 mL甲醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是 ;
(2)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置 (夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用______(填“甲”或“乙”或“丙”)装置。

Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称。操作I 操作Ⅱ

(4)能否用NaOH溶液代替饱和碳酸钠溶液? (填“能”或“否”)并简述原因
(5)通过计算,苯甲酸甲酯的产率为__________________________________。
【答案】
(1)催化剂、吸水剂;
(2)乙;
(3)分液;蒸馏;
(4)否、NaOH是强碱,使苯甲酸甲酯水解,导致产品损失;
(5)65%。
【解析】
试题分析:(1)在该反应中浓硫酸的作用是:催化剂、吸水剂;⑵甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置 (夹持仪器和加热仪器均已略去)。为了提高原料的利用率,根据有机物的沸点,最好采用乙装置;(3) 操作I是分离互不相溶的两层液体混合物的方法,叫分液;操作Ⅱ是分离互溶的、个、沸点不同的液体混合物,是蒸馏;(4) 氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失,所以不能用NaOH溶液代替饱和碳酸钠溶液;(5) 12.2g苯甲酸的物质的量为:n(苯甲酸)=12.2g÷122g/mol=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为n(甲醇)= (0.79g/mL×20mL) ÷32g/mol=0.49mol>0.1mol,所以应该以不足量的苯甲酸为标准计算。则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:(8.84g÷13.6g)×100%=65%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案