题目内容
【题目】研究人员从海底微生物中分离到一种在低温下有催化活性的α-淀粉酶A3,并对其进行了研究。回答下列问题:
(1)在以淀粉为底物测定A3酶活性时,既可检测淀粉的减少,检测应采用的试剂是_________,也可采用斐林试剂检测________的增加。
(2)在A3的分离过程中可采用聚丙烯酰胺凝胶电泳检测其纯度,通常会在凝胶中添加SDS,SDS的作用是___________________和___________________。
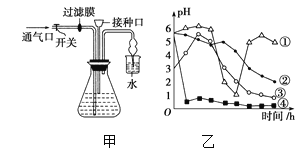
(3)本实验中,研究人员在确定A3的最适pH时使用了三种组分不同的缓冲系统,结果如图所示。某同学据图判断,缓冲系统的组分对酶活性有影响,其判断依据是______________。

(4)在制备A3的固定化酶时,一般不宜采用包埋法,原因是___________________________ (答出1 点即可)。
【答案】碘液 还原糖(或答:葡萄糖) 消除蛋白质所带净电荷对迁移率的影响 使蛋白质发生变性 在pH相同时,不同缓冲系统条件下所测得的相对酶活性不同 酶分子体积小,容易从包埋材料中漏出
【解析】
SDS聚丙烯酰胺凝胶电泳原理:在离子强度低时,主要以单体形式存在的SDS可以与蛋白质结合,生成蛋白质-SDS复合物。由于SDS带有大量负电荷,复合物所带的负电荷远远超过蛋白质原有的负电荷,这使得不同蛋白质间电荷的差异被掩盖。而SDS-蛋白质复合物形状都呈椭圆棒形,棒的长度与蛋白质亚基分子量有关,所以在SDS聚丙烯酰胺凝胶电泳中蛋白只存在分子大小的差别,利用这一点可将不同的蛋白质分开 (分子筛效应),因此SDS-PAGE常用于检测蛋白质亚基的分子量及鉴定纯度。
(1)测定酶活性时,可以通过检测反应物的减少或生成物的增加来反映酶活性,所以可以用碘液检测淀粉的减少,也可用斐林试剂检测还原糖(或葡萄糖)的增加。
(2)鉴定蛋白质纯度常用SDS聚丙烯酰胺凝胶电泳法,凝胶中加入SDS可以消除蛋白质所带净电荷对迁移率的影响,并使蛋白质发生变性。
(3)分析题中曲线可知,在pH相同时,不同缓冲系统条件下所测得的相对酶活性不同,可推测缓冲系统的组分对酶活性有影响。
(4)由于酶分子体积小,容易从包埋材料中漏出,所以固定化酶时,一般不采用包埋法。