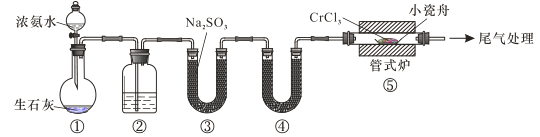
【题目】研究高效催化剂是解决汽车尾气中的 NO 和 CO 对大气污染的重要途径。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃时,在分别装有催化剂 A 和 B 的两个容积为 2 L 的刚性密闭容器中,各充入物质的量均为nmol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表:
时间/min | 0 | 10 | 20 | 30 | ∞ |
A容器内压强/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器内压强/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判断催化剂 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡转化率为 __________。400℃时,用压强表示的平衡常数Kp__________(kPa)-1 (保留两位小数)。
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是 __________。
(3)为研究气缸中NO的生成, 在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应 N2(g)+ O2(g)2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是_________(填序号)。
A.2v正(O2)= v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=l D.容器内温度不变
②为减小平衡混合气中 NO 的体积分数, 可采取的措施是 ___________。
(4)对于缸中NO的生成,化学家提出了如下反应历程:
第一步 O22O 慢反应
第二步 O+N2NO+N 较快平衡
第三步 N+O2NO+O 快速平衡
下列说法错误的是_______(填标号)。
A.第一步反应不从N2分解开始,是因为N2比O2稳定
B.N、O 原子均为该反应的催化剂
C.三步反应中第一步反应活化能最大
D.三步反应的速率都随温度升高而增大