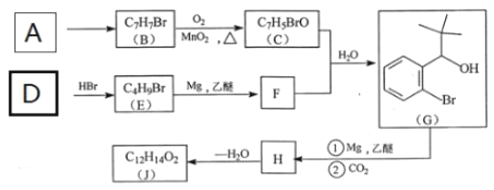
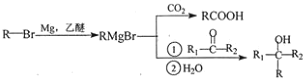
【题目】室温下,1 L含0.1 mol HA和0.1 mol NaA的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
pH | 4.76 | 4.67 | 4.85 |
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法正确的是
A.溶液a和 0.1 mol·L1 HA溶液中H2O的电离程度前者小于后者
B.向溶液a中通入0.1 mol HCl时,A结合H+生成 HA,pH变化不大
C.该温度下HA的Ka=10-4.76
D.含0.1 mol·L1 Na2HPO4 与0.1 mol·L1 NaH2PO4的混合溶液也可做缓冲溶液