【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
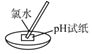
A | 测量氯水的pH |
| pH试纸遇酸变红 |
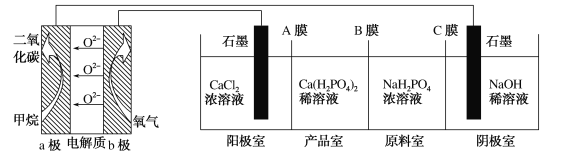
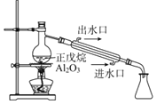
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
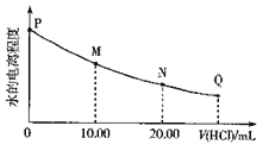
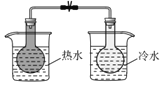
C | 实验温度对平衡移动的影响 |
| 2NO2 |
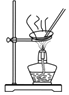
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D
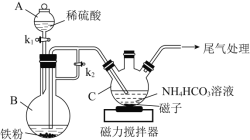
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
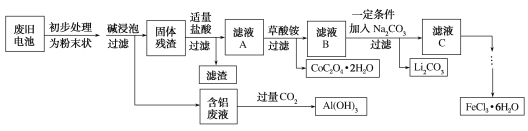
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。