题目内容
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
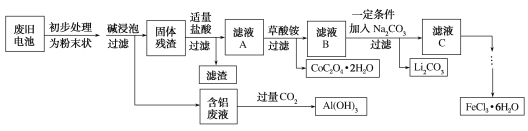
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
【答案】增大接触面积,加快反应速率,提高浸出率 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- FeCl3、CoCl2 2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl C 2CoC2O4+O2![]() 2CoO+ 4CO2 0.02
2CoO+ 4CO2 0.02
【解析】
(1)从反应物呈粉末状接触面积极大对反应的影响来回答;
(2)流程图知含铝废液呈碱性,因此是偏铝酸根溶液中通过量二氧化碳,写得到Al(OH)3的离子方程式;
(3)滤液A的成分,从电池所含的物质与HCl反应来回答,当然要排除已转移到碱液中的铝元素; LiCoO2和盐酸反应的化学方程式,结合信息判断是氧化还原反应,按氧化还原反应规律书写;
(4)滤渣的主要成分为废电池总既不溶于酸又不溶于碱的成分;
(5) 补充完整表中问题,要从所提供的信息、数据,结合元素质量守恒定律计算得出;
(6)离子浓度的计算,先要用浓度是和KSP的关系判断是否有碳酸锂沉淀,如有沉淀,结合数据计算,如没有沉淀,则就是混合溶液中离子的浓度;
废旧钴酸锂镍离子电池主要含有Fe、Al、碳的单质和LiCoO2,初步处理,加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,固体残渣为:Fe、C的单质和LiCoO2,加盐酸Fe+2H+=Fe2++H2↑,2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O,残渣为C,滤液A为Fe3+、Li+、Co3+、Cl-,加入草酸铵,过滤沉淀为CoC2O42H2O,滤液B为:Fe3+、Li+、Cl-,加入碳酸钠,发生的离子反应为2Li++CO32-=Li2CO3↓,滤液C为Fe3+、Cl-,加入氧化剂防止铁离子被还原,得氯化铁溶液;
(1)废旧电池初步处理为粉末状的目的是:增大接触面积,加快反应速率,提高浸出率;
答案为:增大接触面积,加快反应速率,提高浸出率;
(2) 偏铝酸钠溶液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,因此从含铝废液得到Al(OH)3的离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3) LiCoO2中Li为+1价,Co为+3价,具有氧化性,HCl中-1价的氯具有还原性,向固体残渣中加入盐酸时,发生氧化还原反应,Co(+3→+2),Cl(-1→0),反应表示为:2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O或2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl;,滤液A为Fe3+、Li+、Co3+、Cl-,故滤液A中的溶质为HCl、LiCl、FeCl3、CoCl2;
答案为:FeCl3、CoCl2;2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl;
(4)上述分析可知,滤渣的主要成分为C;
答案为:C;
(5) 在空气中加热一定质量的CoC2O4·2H2O固体样品时,首先失去结晶水,在120~220℃时,固体失重率为19.76%,生成产物为CoC2O4;
由①可知,在120~220℃时,CoC2O4·2H2O完全失去结晶水生成CoC2O4,然后继续升高温度加热,则CoC2O4分解生成氧化物,其分解失去的质量为183g×59.02%=108g,剩余的质量为183g-108g=75g,设产物的化学式为CoOx,则59+16x=75,解得x=1,则化学式为CoO,则反应方程式为:2CoC2O4+O2![]() 2CoO+ 4CO2;
2CoO+ 4CO2;
答案为:2CoC2O4+O2![]() 2CoO+ 4CO
2CoO+ 4CO
(6) 将浓度为0.02molL-1的Li2SO4和浓度为0.02molL-1的Na2CO3溶液等体积混合,混合瞬间溶液中c(Li+) =0.02mol/L,c(CO32-) =0.01mol/L,计算浓度商![]() =4×10-6<Ksp=8.64×10-4,无沉淀生成,则此时溶液中Li+浓度为0.02mol/L;
=4×10-6<Ksp=8.64×10-4,无沉淀生成,则此时溶液中Li+浓度为0.02mol/L;
答案为:0.02。

 名校课堂系列答案
名校课堂系列答案【题目】甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质之间通过一步反应不能实现如图所示转化的是( )
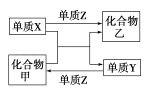
选项 | X | Y | Z | 甲 | 乙 |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D