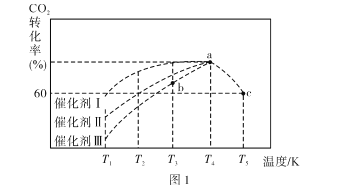
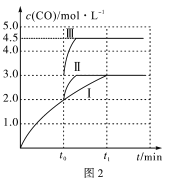
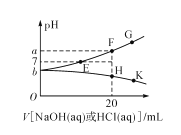
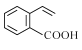
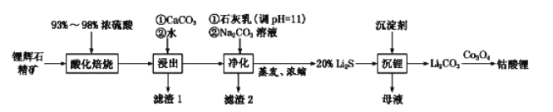
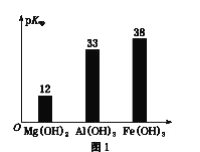
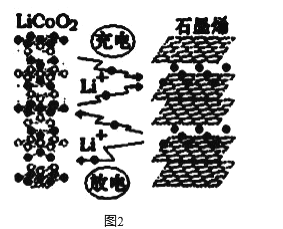
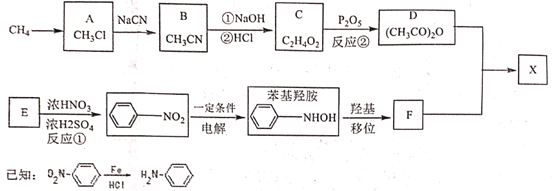
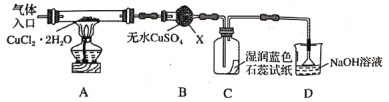
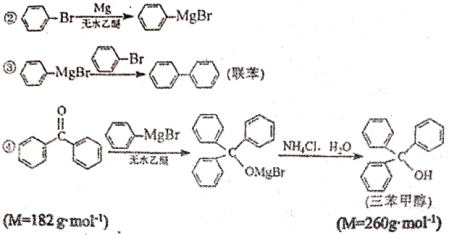
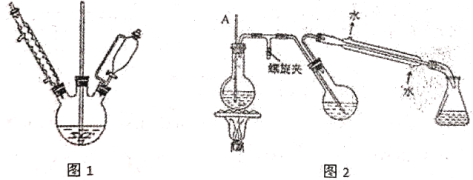
0 202681 202689 202695 202699 202705 202707 202711 202717 202719 202725 202731 202735 202737 202741 202747 202749 202755 202759 202761 202765 202767 202771 202773 202775 202776 202777 202779 202780 202781 202783 202785 202789 202791 202795 202797 202801 202807 202809 202815 202819 202821 202825 202831 202837 202839 202845 202849 202851 202857 202861 202867 202875 203614