【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
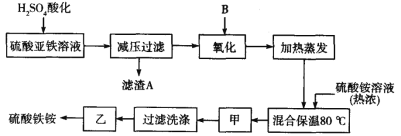
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图:
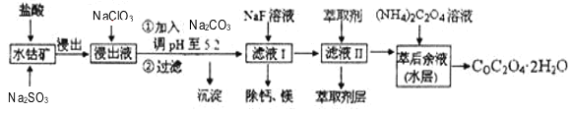
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是_____。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为_____。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____。
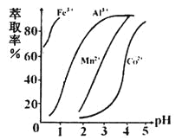
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,在滤液II中适宜萃取的pH为_____左右。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液![]() =____。
=____。
(6)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K=1.8×10-5,H2SO3的电离平衡常数K1=1.2×10-2,K2=1.3×10-8。在通废气的过程中,当恰好形成正盐时,溶液中离子浓度的大小关系为____。
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)