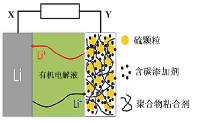
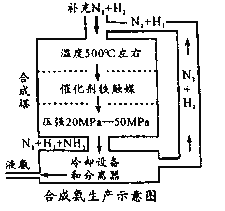
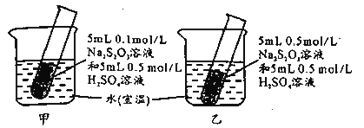
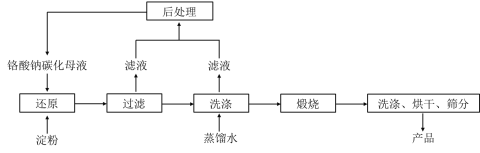
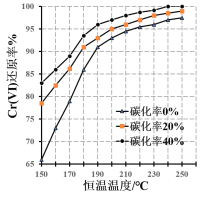
0 202541 202549 202555 202559 202565 202567 202571 202577 202579 202585 202591 202595 202597 202601 202607 202609 202615 202619 202621 202625 202627 202631 202633 202635 202636 202637 202639 202640 202641 202643 202645 202649 202651 202655 202657 202661 202667 202669 202675 202679 202681 202685 202691 202697 202699 202705 202709 202711 202717 202721 202727 202735 203614