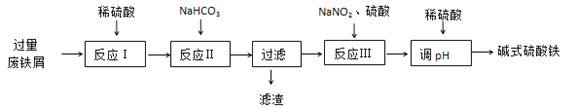
【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 ___________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_____________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=_____mol。
(5)用稀硫酸调节体系的pH时,若硫酸加入量过少,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理说明其原因______________________________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________