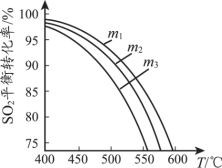
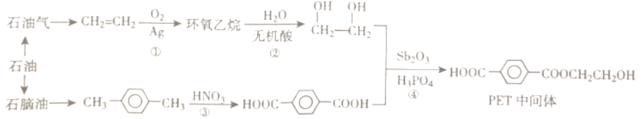
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
【题目】Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是_____________(填字母).
a、溶液中c(H+)>c(OH) b、NH4+水解是微弱的
c、NH3H2O是弱碱 d、由H2O电离出的c(H+)<107mol/L
e、物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是____________(填序号).
②滴定醋酸溶液的过程中:
i、V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为________________________.
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”).
Ⅱ.复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1molL1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______(填编号).
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05molL1的下列5种物质的溶液中,pH最小的是______(填编号),其pH值为______(填数值);pH最大的是______(填编号).
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4