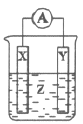
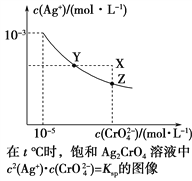
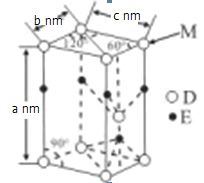
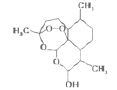
0 201352 201360 201366 201370 201376 201378 201382 201388 201390 201396 201402 201406 201408 201412 201418 201420 201426 201430 201432 201436 201438 201442 201444 201446 201447 201448 201450 201451 201452 201454 201456 201460 201462 201466 201468 201472 201478 201480 201486 201490 201492 201496 201502 201508 201510 201516 201520 201522 201528 201532 201538 201546 203614