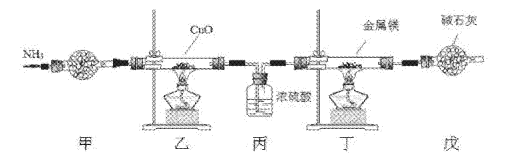
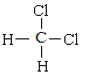
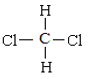
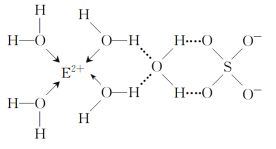
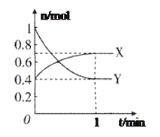
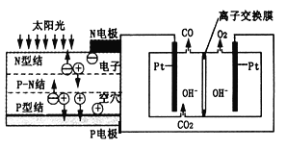
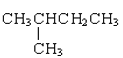0 200779 200787 200793 200797 200803 200805 200809 200815 200817 200823 200829 200833 200835 200839 200845 200847 200853 200857 200859 200863 200865 200869 200871 200873 200874 200875 200877 200878 200879 200881 200883 200887 200889 200893 200895 200899 200905 200907 200913 200917 200919 200923 200929 200935 200937 200943 200947 200949 200955 200959 200965 200973 203614