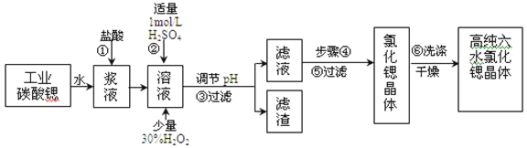
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
已知:I.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
II.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
⑴在步骤②中加入少量的30% H2O2,反应的离子方程式_______________。
⑵在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为__________。过滤所得滤渣的主要成分是_______________。
⑶关于上述流程中的步骤④、⑤、⑥的说法,正确的是____________。
A. 步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B. 可以通过降低结晶速率的方法来得到较大颗粒的SrCl26H2O晶体
C. 某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D. 步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和![]() 溶液
溶液
⑷工业上采用减压烘干或者用50~60℃的热风吹干SrCl26H2O晶体的原因是______________。
⑸为了测定所得SrCl26H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的硝酸银溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl26H2O晶体样品的纯度。用去上述浓度的NH4SCN溶液20.00mL,则原SrCl26H2O晶体的纯度为_____________________。