题目内容
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P的化合物。由黑钨矿冶炼钨的工艺流程如下图:
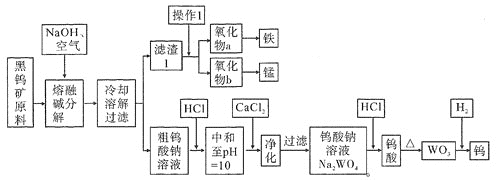
已知:
①滤渣1的主要成份是Fe3O4、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下,钨酸难溶于水,钨酸钙(CaWO4)微溶于水。
回答下列问题:
⑴钨酸盐(FeWO4、MnWO4)中钨元素的化合价为________,为了加快黑钨矿在空气中熔融碱分解速率,可以采取_____________措施(写出其中一种即可)。
⑵请写出FeWO4在熔融条件下发生碱分解反应生成Fe3O4的化学方程式_________________________。
⑶操作1是工业上分离矿石的一种物理方法,此方法是_____________________________。上述流程中向粗钨酸钠溶液中加HCl调pH = 10后,溶液中的杂质阴离子为SiO32-、PO43-等,则“净化”过程中,加CaCl2的作用是____________________________________________。
⑷磷有两种同素异形体白磷和红磷,白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成Cu3P(Cu为+1价),反应方程式如下![]() 未配平
未配平![]() 。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________。
。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________。
CuSO4 + P4 + H2O = Cu3P + H2SO4+ H3PO4(未配平)
【答案】+6 粉碎原料![]() 适当增加空气量或搅拌等
适当增加空气量或搅拌等![]() 6FeWO4 + O2 + 12NaOH
6FeWO4 + O2 + 12NaOH ![]() 2Fe3O4+6 Na2WO4 + 6H2O 磁选(或其他合理答案) 生成CaSiO3、Ca3(PO4)2沉淀而除去 10mol
2Fe3O4+6 Na2WO4 + 6H2O 磁选(或其他合理答案) 生成CaSiO3、Ca3(PO4)2沉淀而除去 10mol
【解析】
⑴钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,根据化合物中正负化合价代数和为零得出;为了加快黑钨矿在空气中碱分解速率,可以采取粉碎原料、适当增加空气量、搅拌等措施;
⑵根据流程图的提示知,利用氧化还原反应写出黑钨矿在空气中熔融生成Fe3O4化学反应方程式;
⑶磁选是利用各种矿石或物料的磁性差异;溶液中的杂质阴离子为SiO32-、PO43-与CaCl2的反应生成CaSiO3、Ca3(PO4)2沉淀;
⑷根据氧化还原反应配平,根据氧化还原反应原理分析被氧化与物质的消耗关系。
⑴钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+2+x+(-2)×4=0,解得x = +6;为了加快黑钨矿在空气中碱分解速率,可以采取粉碎原料、适当增加空气量、搅拌等措施;故答案为:+6;粉碎原料(适当增加空气量、搅拌等措施);
⑵根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、Fe3O4、MnO2等,其中转化生成Fe3O4的化学反应方程式为6FeWO4 + O2 + 12NaOH ![]() 2Fe3O4+6 Na2WO4 + 6H2O;故答案为:6FeWO4 + O2 + 12NaOH
2Fe3O4+6 Na2WO4 + 6H2O;故答案为:6FeWO4 + O2 + 12NaOH ![]() 2Fe3O4+6 Na2WO4 + 6H2O;
2Fe3O4+6 Na2WO4 + 6H2O;
⑶磁选是利用各种矿石或物料的磁性差异,在磁力及其他力作用下进行选别的过程,Fe3O4是磁性氧化铁,可以通过磁选实现和MnO2的分离;上述流程中向粗钨酸钠溶液中加HCl调pH =10后,溶液中的杂质阴离子为SiO32-、PO43-等,则“净化”过程中,加CaCl2的作用是生成CaSiO3、Ca3(PO4)2沉淀而除去;故答案为:磁选(或其他合理答案);生成CaSiO3、Ca3(PO4)2沉淀而除去;
⑷根据氧化还原反应配平60CuSO4 +11P4 +60 H2O = 20Cu3P + 60H2SO4+24H3PO4,反应中有6mol白磷被氧化,消耗60mol硫酸铜,所以当被氧化的白磷的物质的量为1mol,消耗的硫酸铜的物质的量为10mol。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案