【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
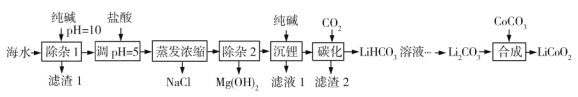
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
【题目】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______。
化学键 | C-H | H-H | C-O | C≡O | O-H |
键能/ kJ·mol-1 | a | b | c | x | d |
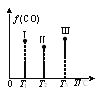
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____。
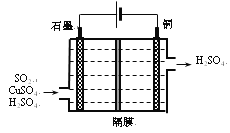
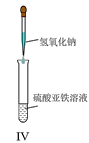
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
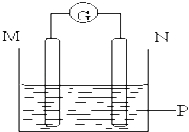
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D