题目内容
【题目】燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______g。
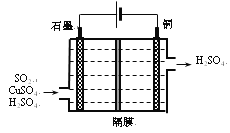
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为_______。
【答案】SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1 3 8 SO2+2H2O+Cu2+![]() 4H++SO
4H++SO![]() +Cu CH4-8e-+10OH-=CO
+Cu CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
【解析】
根据题干要求书写热化学方式,运用盖斯定律计算放热;根据氧化还原反应中电子转移守恒进行相关计算;根据反应方程式及气体摩尔体积进行相关计算;根据电解质及燃料电池原理书写电极反应式。
(1)根据盖斯定律得:由I 2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH1=a kJ·mol-1;II H2S(g)=H2(g)+S(s) ΔH2=b kJ·mol-1; III H2O(l)=H2O(g) ΔH3=c kJ·mol-1;得I-2II+2III:SO2(g)+2H2(g)=S(s)+2H2O(g), ΔH=ΔH1-2ΔH1+2ΔH1=(a-2b+2c) kJ·mol—1,所以热化学方程式为:SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1,故答案为:SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1;
(2)该反应为氧化还原反应,根据电子得失守恒分析得: 硫元素得电子数目为:(+4-0)×1mol=4mol,ZnFe2O4中铁元素化合价为+3,ZnFe2Ox中铁元素化合价为x-1,铁元素失电子数目为[3-(x-1)]×4mol=4mol,则x=3:故答案为:3;
(3)①2SO2+ O2= 2SO3
44.8L 32g
11.2L m
解得m=8g;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+2H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应相加得:SO2+2H2O+Cu2+![]() 4H++SO
4H++SO![]() +Cu;甲烷燃料电池中,甲烷为负极,失电子发生氧化反应,因为电解质呈碱性,则产物为碳酸根,负极反应式为:CH4-8e-+10OH-=CO
+Cu;甲烷燃料电池中,甲烷为负极,失电子发生氧化反应,因为电解质呈碱性,则产物为碳酸根,负极反应式为:CH4-8e-+10OH-=CO![]() ,故答案为:8; SO2+2H2O+Cu2+
,故答案为:8; SO2+2H2O+Cu2+![]() 4H++SO
4H++SO![]() +Cu;CH4-8e-+10OH-=CO
+Cu;CH4-8e-+10OH-=CO![]() 。
。

 名校课堂系列答案
名校课堂系列答案