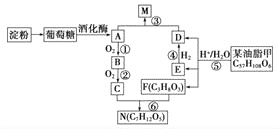
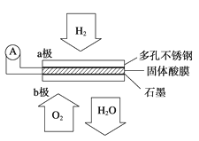
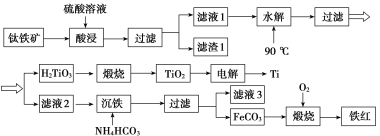
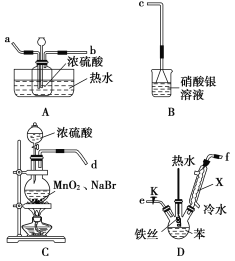
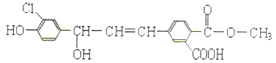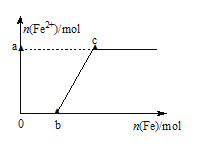0 200266 200274 200280 200284 200290 200292 200296 200302 200304 200310 200316 200320 200322 200326 200332 200334 200340 200344 200346 200350 200352 200356 200358 200360 200361 200362 200364 200365 200366 200368 200370 200374 200376 200380 200382 200386 200392 200394 200400 200404 200406 200410 200416 200422 200424 200430 200434 200436 200442 200446 200452 200460 203614