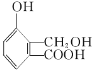
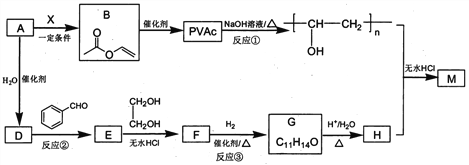
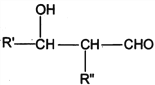
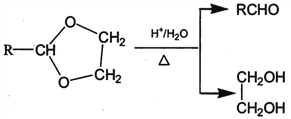
【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数