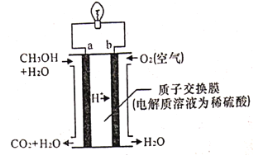
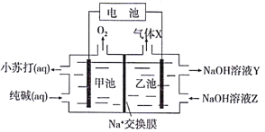
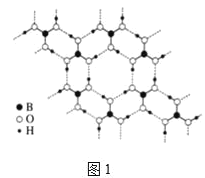
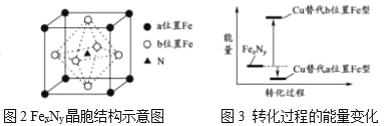
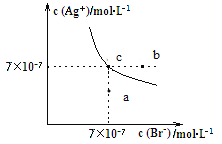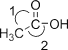【题目】.二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) ![]() HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
实验编号 | 时间/min | 60 | 90 | 120 | 150 | 180 |
Ⅰ | T1/K | 1.50mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
Ⅱ | T2/K | 1.45mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)实验I中0~60min内用HCOOH表示的该反应的平均反应速率为____________。
(2)实验II反应开始时体系压强为P0,第90min时体系压强为P1,则P1:P0=_______。
(3)T2温度下反应的平衡常数为______________。
(4)比较实验温度T1____T2(填“>”或“<”),该反应的△H____0(填“>”、“=”或“<”)。
(5)下列说法正确的是_______(填编号)。
A.当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡
B.容器中气体密度不再改变,不能判断该反应是否达到平衡
C.将HCOOH液化后分离既能提高转化率又能加快反应速率
D.选用更高效的催化剂可提高生产效率