【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,其实验数据如下:
2SO3(g)为放热反应,其实验数据如下:
压强/Mpa 转化率 温度/℃ | 0.1 | 0.5 | 1 | 5 | 10 |
450 | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
550 | 85.6% | 92.9% | 94.2% | 97.7% | 98.3% |
(1)应选用的温度是________,其理由是______________________________。
(2)应选用的压强是________,其理由是_________________________。
【题目】某小组用实验I验证Fe2(SO4)3与Cu的反应,观察到了异常现象,决定对其进行深入探究。
实验I:
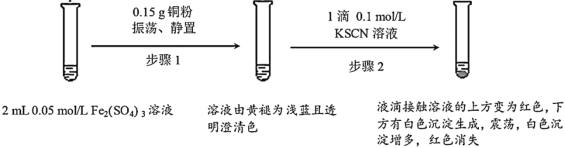
(1)Fe2(SO4)3溶液常温下呈酸性的原因是___。
(2)Fe2(SO4)3与KSCN溶液反应的离子方程式为___。
(3)实验前,小组同学预测经过步骤2后溶液不应该呈现红色,依据是__。
(4)实验小组对白色沉淀的产生进行了深入探究
查阅资料:i.CuSCN为难溶于水的白色固体。
ii.SCN-被称为拟卤素离子,性质与卤素离子相似
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能
猜测1:Cu2+与KSCN发生了氧化还原反应
猜测2:亚铁离子将其还原Cu2++Fe2+=Cu++Fe3+,Cu++SCN-=CuSCN↓
为证实猜想小组同学做了实验II和III。(FeSO4和CuSO4溶液浓度为0.1mol/L,KSCN溶液浓度为0.4mol/L)
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
II |
| 加入1mLKSCN溶液 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
| 加入1mLKSCN溶液 | 溶液变成绿色 |
①猜测1的离子方程式____;
②实验II中试管__(填字母)中的现象可以证实猜测1不成立。
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈红色 | ||
| 加入4mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈浅红色 | ||
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
(5)Fe3+的氧化性本应强于Cu2+,结合实验III中的现象解释Cu2++Fe2+=Cu++Fe3+能正向发生的原因是___。
(6)实验小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是___。