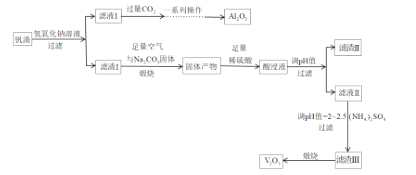
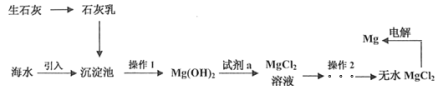
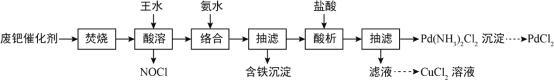
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
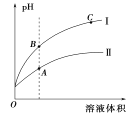
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) ![]() 2NO2(g)△H=-110kJ·mol-1
2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kPa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是______________。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为_______(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) ![]() 2NO2(g)有如下两步历程
2NO2(g)有如下两步历程
第一步2NO(g) ![]() N2O2(g) 快速反应
N2O2(g) 快速反应
第二步N2O2(g)+O2(g) ![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
总反应速率主要由第_____步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃)______P(25℃)(填“大于”、“等于”或“小于”)。
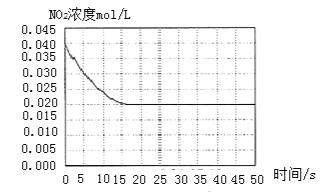
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=______
(3)该温度下反应2NO(g)+O2(g) ![]() 2NO2(g)的化学平衡常数K为______。
2NO2(g)的化学平衡常数K为______。