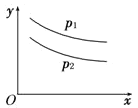
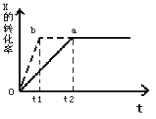
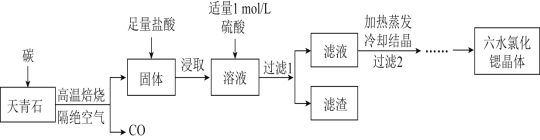
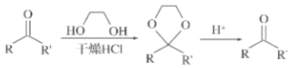
0 198050 198058 198064 198068 198074 198076 198080 198086 198088 198094 198100 198104 198106 198110 198116 198118 198124 198128 198130 198134 198136 198140 198142 198144 198145 198146 198148 198149 198150 198152 198154 198158 198160 198164 198166 198170 198176 198178 198184 198188 198190 198194 198200 198206 198208 198214 198218 198220 198226 198230 198236 198244 203614