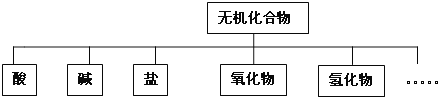
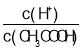【题目】元素①~⑩在周期表中的位置如下表所示:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
回答下列问题:
(1)最外层电子数为2的元素有________(填元素符号);⑨的简单离子结构示意图为________,①与⑥以原子个数比为1:1形成的化合物的电子式为________,用电子式表示⑦与⑩形成化合物的过程________________________。
(
(3)高温灼烧⑦与⑩两种元素形成的化合物时,火焰呈________色。⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为________。
(4)④、⑤、⑥的气态氢化物中最稳定的是________。
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。已知:Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解。
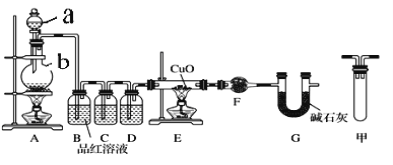
①填写仪器名称:a___________、b___________。
②研究小组认为还可能产生氢气的理由是:_____________________。
③装置D中加入的试剂是__________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是______________________________。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是______。
【题目】下述实验操作中,正确的是( )
|
|
|
|
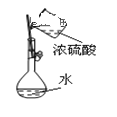
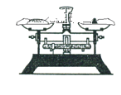
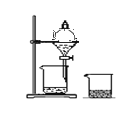
A.配制硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | B.用托盘天平称量药品时,将药品置于天平左盘 | C.将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | D.分液时,将上下层液体依次从分液漏斗下口分别流入两个烧杯中 |
A.AB.BC.CD.D
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O