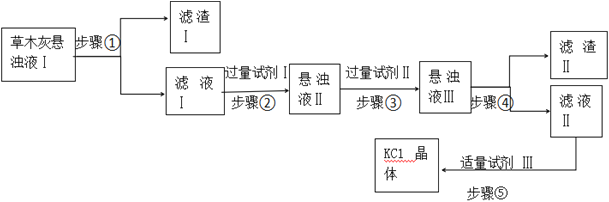
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
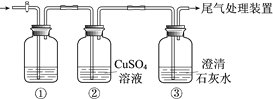
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
【题目】学习小组研究钠的燃烧反应产物,取金属钠(表面已被氧化),吸干煤油,置于坩埚内,上方倒扣盛满O2集气瓶,加热一段时间,充分反应后观察到产物为白色固体和淡黄色固体的混合物,测得反应前后各物质的质量如下表:
质量/g | ||
反应前 | 坩埚 | 100 |
盛有金属钠的坩埚 | 105.4 | |
反应后 | 盛有固体产物的坩埚 | 107.4 |
请回答下列问题:
(1)根据实验现象,推测固体产物成分为___________________(填化学式)
(2)将产物全部溶于水,观察到有气泡生成,写出该反应的化学方程式为________。
(3)测得上述溶液中n(Na+)=0.2mol,通过计算证实加热过程中存在表面的Na2O转化为Na2O2。___________________
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D