化学与社会、生活密切相关。对下列现象或事实的解释正确的选项是
选项 | 现象或事实 | 解释 |
A | 臭氧能用于杀菌消毒 | 臭氧的还原性使细菌的蛋白质变性 |
B | 铁能用于治疗缺铁性贫血 | 铁能与盐酸生成三氯化铁 |
C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
D | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | 高锰酸钾能氧化水果释放的催熟剂乙烯 |
A. A B. B C. C D. D
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
B | 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/LZnSO4溶液;再滴2滴0.1mol/LCuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶解度(Ksp):ZnS>CuS |
C | 在稀硫酸中加入铜,再加入硝酸钠固体 | 开始无现象,后铜逐步溶解,溶液变蓝,有气泡产生 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
A. A B. B C. C D. D
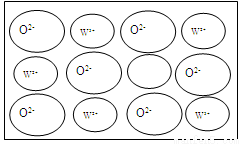
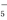 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
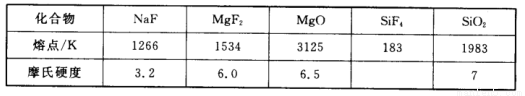
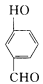 比
比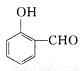 的沸点_______(填“高”或“低”)。
的沸点_______(填“高”或“低”)。