工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
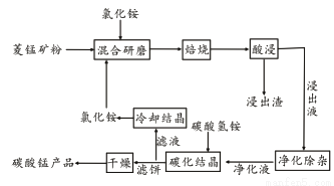
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl  MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
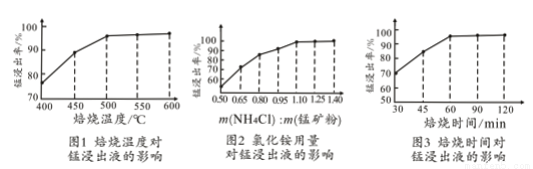
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+ 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+)。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
某溶液中含有大量的K+、Cl-及X与Y两种离子,现向该溶液加入W试剂,根据实验现象得到的关于X、Y离子的推断能成立的是
W试剂 | 实验现象 | X、Y离子的推测 | |
A | KI—淀粉溶液 | 溶液变蓝 | Fe3+、SO42- |
B | 用pH试纸检测 | pH=7(常温) | CH3COO-、Na+ |
C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32-、NH4+ |
D | 过量NaOH溶液 | 无明显现象 | Al3+、Mg2+ |
A. A B. B C. C D. D
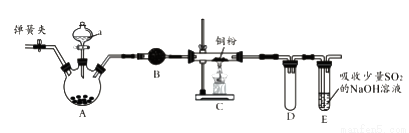
 2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H 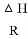 (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。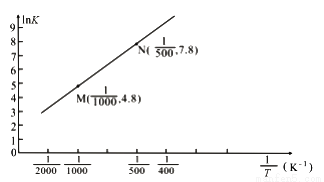

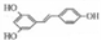 )具有预防心血管疾病的作用,其一种合成路线如下:
)具有预防心血管疾病的作用,其一种合成路线如下: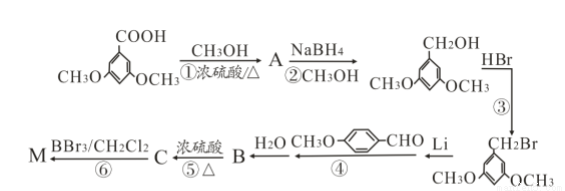
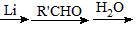


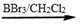
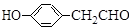
 核磁共振氢谱中不同化学环境的氢原子个数比为___________。
核磁共振氢谱中不同化学环境的氢原子个数比为___________。 有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有_________________种。
有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有_________________种。