0 174583 174591 174597 174601 174607 174609 174613 174619 174621 174627 174633 174637 174639 174643 174649 174651 174657 174661 174663 174667 174669 174673 174675 174677 174678 174679 174681 174682 174683 174685 174687 174691 174693 174697 174699 174703 174709 174711 174717 174721 174723 174727 174733 174739 174741 174747 174751 174753 174759 174763 174769 174777 203614
 2SO3(g),ΔH<0正、逆反应的平衡常数K随温度的变化
2SO3(g),ΔH<0正、逆反应的平衡常数K随温度的变化 CH3CH3(g) ΔH<0使用和未使用催化剂时, 反应过程中的能量变化
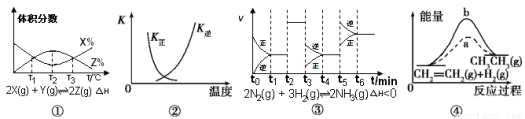
CH3CH3(g) ΔH<0使用和未使用催化剂时, 反应过程中的能量变化 3Z(g) ΔH,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ΔH,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
 H+ + OH-,下列叙述正确的是( )
H+ + OH-,下列叙述正确的是( ) 2PbSO4(s)+2H2O(l)下列说法不正确的是( )
2PbSO4(s)+2H2O(l)下列说法不正确的是( )
 增大
增大 PbSO4(s)+2H2O(l)
PbSO4(s)+2H2O(l) C(g)+ D(g)能表示该反应已达平衡状态的是( )
C(g)+ D(g)能表示该反应已达平衡状态的是( )
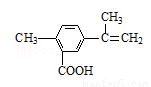
 2SO3(g)△H=﹣196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是(
2SO3(g)△H=﹣196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是(  )
) 见的试剂.
见的试剂.

 应的平衡常数值为
应的平衡常数值为  N2H5+ K=8.5×
N2H5+ K=8.5× CH3OH(g)ΔH
CH3OH(g)ΔH
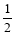 ,与原平衡相比
,与原平衡相比 ,下列有关说法正确的是 (填字母).
,下列有关说法正确的是 (填字母).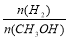 增大;
增大;