5.下列关于钠与水反应的说法不正确的是( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会燃烧
④钠与氧气反应的产物为过氧化钠.
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会燃烧
④钠与氧气反应的产物为过氧化钠.
| A. | 只有①② | B. | 只有②③ | C. | 只有②③④ | D. | ①②③④ |
3.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)═2B(g)+C(g)+D(s)△H=+85.1kJ•mol-1.容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见表:(提示,密闭容器中的压强比等于气体物质的量之比)
回答下列问题:
(1)下列能提高A的转化率的是AE.
A.升高温度 B.体系中通入A气体 C.将D的浓度减小 D.通入稀有气体He,使体系压强增大到原来的5倍 E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K$\frac{c{\;}^{2}(B)•c(C)}{c(A)}$,前2小时C的反应速率是0.02 mol•L-1•h-1;
(3)平衡时A的转化率0.70或70%,C的体积分数29%(均保留两位有效数字);
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围n(D)>0.03mol
(5)已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将amolCH3COONa溶于水配成溶液,向其中滴加等体积的bmol•L-1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=$\frac{10{\;}^{-7}(a-b)}{b}$.
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
(1)下列能提高A的转化率的是AE.
A.升高温度 B.体系中通入A气体 C.将D的浓度减小 D.通入稀有气体He,使体系压强增大到原来的5倍 E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K$\frac{c{\;}^{2}(B)•c(C)}{c(A)}$,前2小时C的反应速率是0.02 mol•L-1•h-1;
(3)平衡时A的转化率0.70或70%,C的体积分数29%(均保留两位有效数字);
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围n(D)>0.03mol
(5)已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将amolCH3COONa溶于水配成溶液,向其中滴加等体积的bmol•L-1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=$\frac{10{\;}^{-7}(a-b)}{b}$.
2.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0.一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,n(Z)=0.24 mol | |
| D. | 其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大 |
1.在0.5L的密闭容器中,一定量的氮气与氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H=a kJ•mol-1,其化学平衡常数K与温度的关系如下.
请回答下列问题.
(1)写出该反应的化学平衡常数表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2),反应需向正方向进行才能达到新的平衡.
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(1)写出该反应的化学平衡常数表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2),反应需向正方向进行才能达到新的平衡.
19..煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表:
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有BCE(选填A、B、C、D、E);
(2)在1L密闭容器中通入10mol CO和10mol水蒸气,在500℃下经过30s达到平衡,则30s内CO的平均反应速率为0.25mol•L-1•s-1;
(3)已知在一定温度下,C(s)+CO2(g)?2CO(g)平衡常数K;K的表达式$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=$\frac{{K}_{1}}{{K}_{2}}$;
(4)某温度下C(s)+CO2(g)?2CO(g)能判断该反应达到化学平衡状态的依据是CEF;
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)?2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.

已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有BCE(选填A、B、C、D、E);
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(3)已知在一定温度下,C(s)+CO2(g)?2CO(g)平衡常数K;K的表达式$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=$\frac{{K}_{1}}{{K}_{2}}$;
(4)某温度下C(s)+CO2(g)?2CO(g)能判断该反应达到化学平衡状态的依据是CEF;
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)?2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.

18.在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:CO(g)+2H2(g)?CH3OH(g).实验测得,300℃下,CH3OH的物质的量随时间的变化如下表所示.
(1)20min内,v(CH3OH)=0.003mol/(L•min).
(2)该温度下反应的化学平衡常数数值为2.25×104 .
(3)H2的平衡转化率是90%.
(4)若实验测得500℃下,到达平衡时n(CH3OH)=0.160mol,则正反应是放热(填“放热”或“吸热”)反应.
| t/min | 10 | 20 | 30 | 40 | 50 | 60 |
| n(CH3OH)/mol | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
(2)该温度下反应的化学平衡常数数值为2.25×104 .
(3)H2的平衡转化率是90%.
(4)若实验测得500℃下,到达平衡时n(CH3OH)=0.160mol,则正反应是放热(填“放热”或“吸热”)反应.
17. 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①已知:K(300℃)>K(350℃),则该反应是放热反应(填“放热”或“吸热”)
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
0 173856 173864 173870 173874 173880 173882 173886 173892 173894 173900 173906 173910 173912 173916 173922 173924 173930 173934 173936 173940 173942 173946 173948 173950 173951 173952 173954 173955 173956 173958 173960 173964 173966 173970 173972 173976 173982 173984 173990 173994 173996 174000 174006 174012 174014 174020 174024 174026 174032 174036 174042 174050 203614
 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
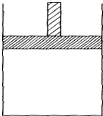 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.