14.为保护环境,洗涤含SO2的烟气.以下物质可作洗涤剂的是( )(填字母代号).
| A. | Ca(OH)2 | B. | CaCl2 | C. | Na2CO3 | D. | NaHSO3 |
13.利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法错误的是( )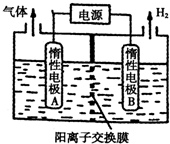

| A. | 惰性电极A为阳极,惰性电极B为阴极 | |
| B. | 电解过程中Li+向A电极迁移 | |
| C. | 阳极电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | B极区电解液为LiOH溶液 |
10.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是( )
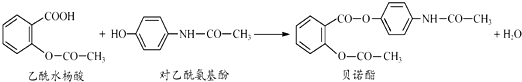

| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 用FeCl3 溶液不能区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 1mol贝诺酯与足量NaOH 溶液共热最多可消耗5molNaOH钠 |
9.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液中;
②除去乙酸乙酯中的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中少量的苯酚:加入足量浓溴水后过滤;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
0 173727 173735 173741 173745 173751 173753 173757 173763 173765 173771 173777 173781 173783 173787 173793 173795 173801 173805 173807 173811 173813 173817 173819 173821 173822 173823 173825 173826 173827 173829 173831 173835 173837 173841 173843 173847 173853 173855 173861 173865 173867 173871 173877 173883 173885 173891 173895 173897 173903 173907 173913 173921 203614
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液中;
②除去乙酸乙酯中的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中少量的苯酚:加入足量浓溴水后过滤;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ②④ | B. | ②③ | C. | ②③④ | D. | 全部正确 |
 氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等.
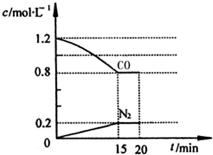
氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等. 2CO2+N2,反应过程中部分物质的浓度变化如图所示:
2CO2+N2,反应过程中部分物质的浓度变化如图所示:
 ;
; -COOH+CH3CHOHCHOHCH3$?_{△}^{浓硫酸}$
-COOH+CH3CHOHCHOHCH3$?_{△}^{浓硫酸}$ -COOCH(CH3)CH(CH3)OOC-
-COOCH(CH3)CH(CH3)OOC-