题目内容
12. 氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等.(1)已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622.2kJ•mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是△H>0,△S<0.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是NaClO+2NH3═N2H4+NaCl+H2O.
(2)采矿废液中的CN-可用H2O2处理,H2O2的制备可通过间接电解硫酸氢钾溶液的方法制备.已知:H2SO4═H++HSO4- HSO4-?H++SO42-,用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-.写出阳极上的电极反应式2HSO4--2e-═S2O82-+2H+.
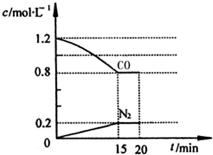
(3)汽车尾气中含有NO和CO,在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的容器中发生反应2NO+2CO
 2CO2+N2,反应过程中部分物质的浓度变化如图所示:
2CO2+N2,反应过程中部分物质的浓度变化如图所示:①写出该反应的化学方程式2NO+2CO
 2CO2+N2.
2CO2+N2.②若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将向左移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是0.14(保留两位有效数字).
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:
①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL;
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热;
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3═(NH4)2B4O7+5H2O];
④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol•L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O═(NH4)2SO4+4H3BO3],记录消耗的体积V mL.则水样中氮元素的含量是2800cVmg•L-1(用含c、V的表达式表示).
分析 (1)①依据热化学方程式和盖斯定律来计算得到;
②依据△H-T△S<0判断反应自发进行;
③次氯酸钠氧化氨气,可以得到N2H4,依据氧化还原反应电子守恒、原子守恒配平写出;
(2)电解池中阴离子在阳极失电子发生氧化反应;
(3)①NO和CO,在一定温度下,根据图可知生成氮气,另外根据元素守恒可知有二氧化碳,且该反应为可逆反应;
②根据平衡时浓度计算其平衡常数,根据浓度商与化学平衡常数相对大小判断平衡移动方向;
(4)依据滴定实验步骤和滴定用量结合化学方程式计算分析得到.
解答 解:(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O,
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
(2)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,HSO4-离子在阳极失电子生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,
故答案为:2HSO4--2e-═S2O82-+2H+;
(3)①NO和CO,在一定温度下,根据图可知生成氮气,另外根据元素守恒可知有二氧化碳,且该反应为可逆反应,反应方程式为2NO+2CO 2CO2+N2,
2CO2+N2,
故答案为:2NO+2CO 2CO2+N2;
2CO2+N2;
②第一次平衡时c(N2)=0.2mol/L,c(CO)=0.8mol/L,c(CO2)=2c(N2)=0.4mol/L,c(NO)=$\frac{2.0mol}{2L}$=0.6mol/L,
化学平衡常数K=$\frac{c{\;}^{2}(CO{\;}_{2}).c(N{\;}_{2})}{c{\;}^{2}(NO).c{\;}^{2}(CO)}$=$\frac{0.4×0.4×0.2}{0.6×0.6×0.8×0.8}$L/mol=$\frac{5}{36}$L/mol=0.14L/mol,
若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,c(CO)=0.8mol/L,c(CO2)=0.4mol/L,c(N2)=0.2mol/L+0.2mol/L=0.4mol/L,c(NO)=0.6mol/L+0.2mol/L=0.8mol/L,
其浓度商=$\frac{0.4×0.4×0.4}{0.8×0.8×0.8×0.8}$L/mol=$\frac{5}{32}$L/mol>$\frac{5}{36}$L/mol,则平衡逆向方向移动,温度不变,化学平衡常数不变,
故答案为:向左;0.14;
(4)依据滴定实验和反应化学方程式可知:
2NH3~(NH4)2B4O7~H2SO4
2 1
2×cV×10-3mol cV×10-3mol
水样中氮的含量=$\frac{2×cV×10{\;}^{-3}mol×14g/mol}{0.01L}$=2.8cV (g/L)=2800cV (mg/L),
故答案为:2800cV.
点评 本题考查了热化学方程式和盖斯定律计算应用,电极原理的分析判断电极书写,实验过程分析理解,滴定实验的计算应用,题目难度中等.

| A. | 质量数为34、中子数为18的核素:${\;}_{16}^{34}$S | |
| B. | S2-的结构示意图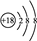 | |
| C. | CS2的结构式:S-C-S | |
| D. | 亚硫酸的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ |
| A. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| B. | 金属汞一旦洒落到实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| C. | 金属钠着火时用泡沫灭火器灭火 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
| A. | 易溶于水 | B. | 碱性 | C. | 酸性 | D. | 还原性 |
| A. | 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
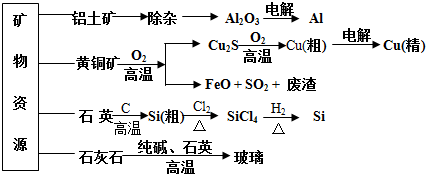
制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料.
| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料. |
| A. | NaCl固体与无水乙醇混合无法形成胶体分散系 | |
| B. | 明矾常用作净水剂,是因为它具有消毒杀菌的作用 | |
| C. | 氨常用作制冷剂,是因为其沸点极低,很容易液化 | |
| D. | SiCl4在战争中常用作烟雾弹,是因为它与水反应时生成白色烟雾 |
| A. | 对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值小于HX溶液的pH改变值 | |
| B. | 在NH3•H2O和NH4Cl浓度均为0.1 mol•L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 | |
| C. | 在NaH2PO4水溶液中存在关系:c(H3PO4)+c(H+)=c(HPO42-)+c(PO43-)+c(OH-) | |
| D. | 沉淀溶解平衡AgI?Ag++I- 的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 |
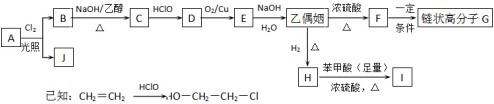
 ;
; -COOH+CH3CHOHCHOHCH3$?_{△}^{浓硫酸}$
-COOH+CH3CHOHCHOHCH3$?_{△}^{浓硫酸}$ -COOCH(CH3)CH(CH3)OOC-
-COOCH(CH3)CH(CH3)OOC-