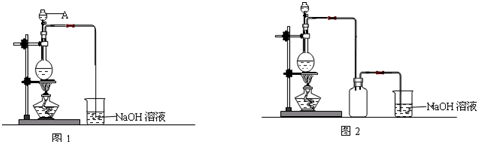
16.下列各项操作或现象能达到预期实验目的是( )
| 选项 | 操作或现象 | 实验目的 |
| A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
| B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
| D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
15.进行化学实验时应强化安全意识,下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 少量金属汞洒落在实验室地面或桌面时,应立即向汞上撒硫黄粉,然后再清扫 |
14.在体积一定的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)其化学平衡常数K和温度t的关系如表,回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选不得分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下SO2的转化反应的2SO2(g)+O2(g)?2SO3(g)平衡常数K=532.4.
下面三个混合体系中各物质的浓度如下表:
试判断各体系反应进行的方向:体系(2)正向;体系(2):已平衡(填正向、逆向或已平衡).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选不得分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下SO2的转化反应的2SO2(g)+O2(g)?2SO3(g)平衡常数K=532.4.
下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
13.室温下由水电离出的H+的浓度是1×10-12mol/L,则该溶液( )
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
12. (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
E.石墨(s).属于强电解质的是AD,能直接导电的是DE.
(2)有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4.若三种溶液的c(H+)相同,其酸溶液物质的量浓度由大到小顺序为①>②>③.
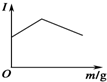
(3)如图是在一定温度下向电解质溶液中加入新物质时溶液的导电性发生的变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与如图变化趋势一致的是②(填序号);
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入氨水至过量
③澄清石灰水中通入CO2至过量
(4)下表是几种弱酸常温下的电离平衡常数:
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为H3PO4>CH3COOH>H2CO3>H2S.
②同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-.
(5)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是10-5-10-9mol•L-1.
 (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)E.石墨(s).属于强电解质的是AD,能直接导电的是DE.
(2)有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4.若三种溶液的c(H+)相同,其酸溶液物质的量浓度由大到小顺序为①>②>③.
(3)如图是在一定温度下向电解质溶液中加入新物质时溶液的导电性发生的变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与如图变化趋势一致的是②(填序号);
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入氨水至过量
③澄清石灰水中通入CO2至过量
(4)下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
②同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-.
(5)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是10-5-10-9mol•L-1.
11.体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是( )
| A. | 分别与足量CaCO3反应时,放出的CO2一样多 | |
| B. | 与NaOH完全中和时,醋酸所消耗的NaOH多 | |
| C. | 两种溶液的pH相等 | |
| D. | 取等体积盐酸和CH3COOH溶液,分别加水稀释a倍和b倍,溶液的pH相等,则a<b |
9.下列离子方程式书写正确的是( )
0 173511 173519 173525 173529 173535 173537 173541 173547 173549 173555 173561 173565 173567 173571 173577 173579 173585 173589 173591 173595 173597 173601 173603 173605 173606 173607 173609 173610 173611 173613 173615 173619 173621 173625 173627 173631 173637 173639 173645 173649 173651 173655 173661 173667 173669 173675 173679 173681 173687 173691 173697 173705 203614
| A. | 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)═2Fe(OH)3+3H2 | |
| B. | 向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |