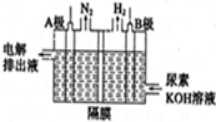
12.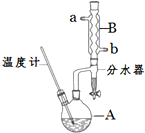 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振荡后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓硫酸,振荡后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(7)本实验中,正丁醚的产率为34%.(保留两位有效数字)
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振荡后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓硫酸,振荡后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(7)本实验中,正丁醚的产率为34%.(保留两位有效数字)
11.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是Ar(填元素符号)
(2)②③⑦三种元素的原子半径从大到小的顺序为Cl>N>O(填元素符号)
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式HClO4,碱性最强的化合物的名称氢氧化钾.
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O.
(5)元素⑥和⑦形成的气态氢化物较稳定是HCl(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实Cl2+H2S=S↓+2HCl(一个或两个方程式均可)
(6)表示①与③形成的化合物的电子式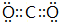 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)②③⑦三种元素的原子半径从大到小的顺序为Cl>N>O(填元素符号)
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式HClO4,碱性最强的化合物的名称氢氧化钾.
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O.
(5)元素⑥和⑦形成的气态氢化物较稳定是HCl(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实Cl2+H2S=S↓+2HCl(一个或两个方程式均可)
(6)表示①与③形成的化合物的电子式
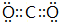 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等.
10.已知2Al+2NaOH+2H2O→2NaAlO2+3H2↑.对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
| A. | 每生成0.6mol H2,被还原的水分子数目为1.2NA | |
| B. | 有2.7g Al参加反应时,转移的电子数目为0.3NA | |
| C. | 有6.72L H2生成时,反应中转移的电子数目为0.6NA | |
| D. | 溶液中每增加0.1mol AlO${\;}_{2}^{-}$,Na+的数目就增加0.1NA |
9.某无色溶液能与铝作用放出H2,则下列离子组合中可能的是( )
| A. | H+、Cl-、Cu2+、Ba2+ | B. | OH-、NO${\;}_{3}^{-}$、Ba2+、Cl- | ||
| C. | H+、CO${\;}_{3}^{2-}$、Mg2+、Ba2+ | D. | OH-、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Mg2+ |
8.在前一种溶液中慢慢滴加后一种试剂,能观察到先生成沉淀后变澄清的是( )
①氯化铝溶液中滴加氢氧化钠溶液,②偏铝酸钠溶液中加盐酸,③氢氧化钠溶液中滴加氯化铝溶液,④氯化铝溶液中滴加氨水.
0 173507 173515 173521 173525 173531 173533 173537 173543 173545 173551 173557 173561 173563 173567 173573 173575 173581 173585 173587 173591 173593 173597 173599 173601 173602 173603 173605 173606 173607 173609 173611 173615 173617 173621 173623 173627 173633 173635 173641 173645 173647 173651 173657 173663 173665 173671 173675 173677 173683 173687 173693 173701 203614
①氯化铝溶液中滴加氢氧化钠溶液,②偏铝酸钠溶液中加盐酸,③氢氧化钠溶液中滴加氯化铝溶液,④氯化铝溶液中滴加氨水.
| A. | ①② | B. | ②③④ | C. | ①②④ | D. | ③④ |
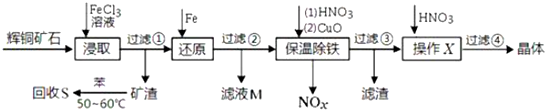
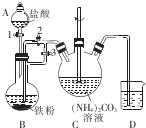 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.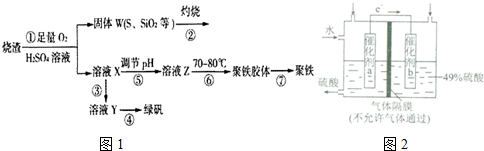

 H2O2+
H2O2+ 6H+=
6H+= Mn2++
Mn2++ O2↑+
O2↑+ 8H2O;
8H2O;