18.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 在溶液中滴加盐酸酸化,在滴加硝酸钡溶液,若有白色沉淀生成则含有SO42- | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体可能是CO2 |
14.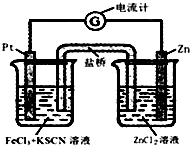 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
13.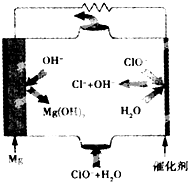 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 池总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正极反应式为ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 该燃料电池中镁为负极,发生还原反应电 | |
| D. | 放电过程中OH-移向负极 |
12.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期ⅠA族;元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填化学式).
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物中化学键的类型为离子键、共价键.
(3)Y和Z均由元素①组成,反应Y+2I-+2H+═I2+Z+H2O常作为Y的鉴定反应.
Ⅰ.Y与Z的关系是(选填字母)b.
a.同位素 b.同素异形体 c.同系物 d.同分异构体
Ⅱ.将Y和二氧化硫分别通入品红溶液,都能使品红褪色.简述用褪色的溶液区分二者的实验方法:加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3
(4)元素⑤的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4Q kJ/mol.
(5)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应式:O2+4e-+2H2O═4OH-.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期ⅠA族;元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填化学式).
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物中化学键的类型为离子键、共价键.
(3)Y和Z均由元素①组成,反应Y+2I-+2H+═I2+Z+H2O常作为Y的鉴定反应.
Ⅰ.Y与Z的关系是(选填字母)b.
a.同位素 b.同素异形体 c.同系物 d.同分异构体
Ⅱ.将Y和二氧化硫分别通入品红溶液,都能使品红褪色.简述用褪色的溶液区分二者的实验方法:加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3
(4)元素⑤的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4Q kJ/mol.
(5)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应式:O2+4e-+2H2O═4OH-.
9.下列有关实验的叙述正确的是( )
0 173466 173474 173480 173484 173490 173492 173496 173502 173504 173510 173516 173520 173522 173526 173532 173534 173540 173544 173546 173550 173552 173556 173558 173560 173561 173562 173564 173565 173566 173568 173570 173574 173576 173580 173582 173586 173592 173594 173600 173604 173606 173610 173616 173622 173624 173630 173634 173636 173642 173646 173652 173660 203614
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验需要480mL 2.0mol•L-1的氢氧化钠溶液.配制该溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| D. | 用溴水,淀粉、KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
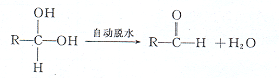
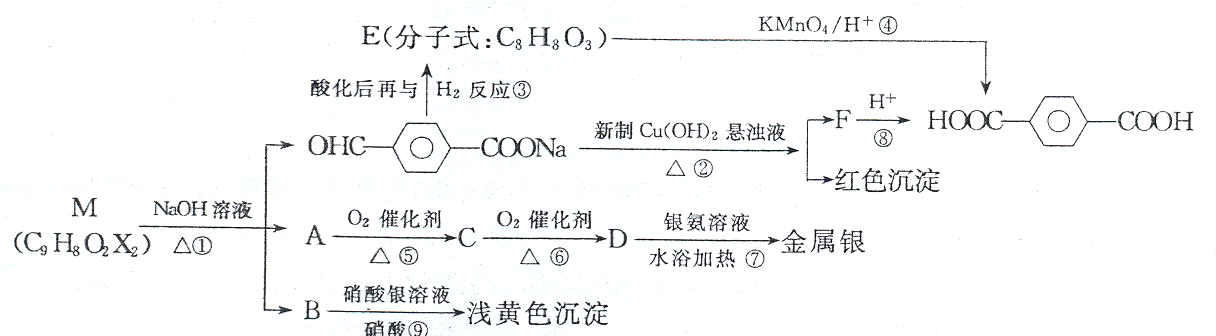
 .
. 、
、 .
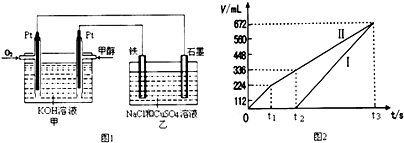
.
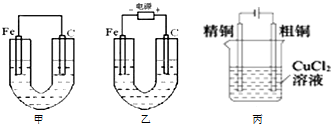 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.