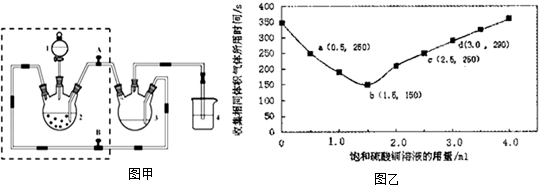
11. 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
0 173367 173375 173381 173385 173391 173393 173397 173403 173405 173411 173417 173421 173423 173427 173433 173435 173441 173445 173447 173451 173453 173457 173459 173461 173462 173463 173465 173466 173467 173469 173471 173475 173477 173481 173483 173487 173493 173495 173501 173505 173507 173511 173517 173523 173525 173531 173535 173537 173543 173547 173553 173561 203614
 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )| A. | 升高温度,平衡正移 | |
| B. | 使用催化剂,D的百分含量增加 | |
| C. | m<p+q | |
| D. | B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动 |
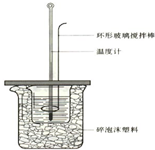 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题: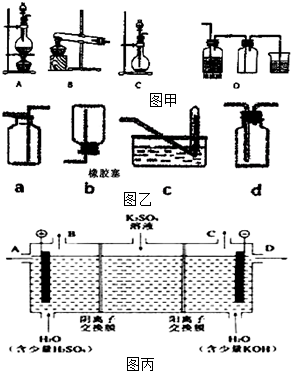 实验室常用的几种气体发生装置如图甲A、B、C所示:
实验室常用的几种气体发生装置如图甲A、B、C所示: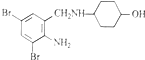 ,不考虑立体异构)是临床上使用广泛的祛痰药.下图所示是其多条合成路线中的一条(反应试剂和反应条件均未标出).
,不考虑立体异构)是临床上使用广泛的祛痰药.下图所示是其多条合成路线中的一条(反应试剂和反应条件均未标出).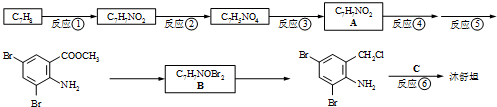
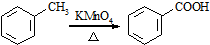 ,(2)反应③为还原反应
,(2)反应③为还原反应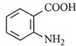 B
B 试剂C
试剂C
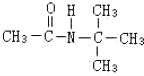 、
、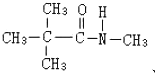 .
.