13.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气.已知:
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3 kJ•mol-1 | |
| C. | N2H4(g)+N2O4(g)═N2(g)+2H2O(g)△H=-1076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ•mol-1 |
6.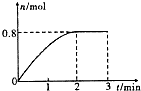 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2 min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 开始到平衡,用A表示该反应的化学反应速率为0.3mol•L-1•min-1 |
5.有一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)?2HBr(g)已知加入1molH2和2molBr2时,达到平衡后,生成amolHBr.在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡时各组分的物质的量分数不变,以下推断不正确的是( )
| A. | 达平衡时HBr物质的量可能仍为amol | |
| B. | x、y、z应满足的关系是4x+z=2y | |
| C. | 达到平衡时HBr物质的量为 $\frac{(x+y+z)a}{3}$mol | |
| D. | x、y、z一定满足关系y=2x |
4.已知反应2N2O5(g)?4NO2(g)+O2(g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下:
下列有关叙述不正确的是( )
0 173349 173357 173363 173367 173373 173375 173379 173385 173387 173393 173399 173403 173405 173409 173415 173417 173423 173427 173429 173433 173435 173439 173441 173443 173444 173445 173447 173448 173449 173451 173453 173457 173459 173463 173465 173469 173475 173477 173483 173487 173489 173493 173499 173505 173507 173513 173517 173519 173525 173529 173535 173543 203614
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
| A. | 340K时,速率表达式中m=1 | |
| B. | 340K时,速率表达式中k正≈0.35min-1 | |
| C. | 340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.035mol.L-1.min-1 | |
| D. | 若t=2min时升高温度,则m不变,k正减小 |