题目内容
5.有一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)?2HBr(g)已知加入1molH2和2molBr2时,达到平衡后,生成amolHBr.在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡时各组分的物质的量分数不变,以下推断不正确的是( )| A. | 达平衡时HBr物质的量可能仍为amol | |
| B. | x、y、z应满足的关系是4x+z=2y | |
| C. | 达到平衡时HBr物质的量为 $\frac{(x+y+z)a}{3}$mol | |
| D. | x、y、z一定满足关系y=2x |
分析 反应H2(g)+Br2(g)?2HBr(g)前后气体体积不变,恒温恒容下,改变起始投入量,按化学计量数转化方程式左边满足n(H2):n(Br2)=1mol:2mol=1:2,则与原平衡为等效平衡,平衡相同组分的含量相等,据此结合选项解答.
解答 解:反应H2(g)+Br2(g)?2HBr(g)前后气体体积不变,恒温恒容下,改变起始投入量,按化学计量数转化方程式左边满足n(H2):n(Br2)=1mol:2mol=1:2,则与原平衡为等效平衡,平衡相同组分的含量相等.
A.若改变起始投入量,按化学计量数转化方程式左边满足n(H2)=1mol、n(Br2)=2mol,则平衡时相同组分的物质的量相等,故达平衡时HBr物质的量可能仍为amol,故A正确;
B.按化学计量数转化方程式左边满足n(H2):n(Br2)=1mol:2mol=1:2,则(x+$\frac{1}{2}$z):(y+$\frac{1}{2}$z)=1:2,整理可得4x+z=2y,故B正确;
C.原平衡时HBr的物质的量分数为$\frac{a}{3}$,则改变起始投入量,达到平衡时HBr物质的量为 $\frac{(x+y+z)a}{3}$mol,故C正确;
D.由B中分析可知,x、y、z一定满足关系4x+z=2y,若没有Z时满足y=2x,故D错误,
故选:D.
点评 本题考查化学平衡计算,涉及等效平衡,关键是理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
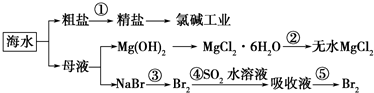

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度看氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩富集,提高Br2的浓度 |
8.镍氢充电电池(Ni-MH,K0H作为电解液)已经开始用于汽油/电动混合动力汽车上,工作时该电池的总反应方程式如下:NiOOH+MH═Ni(OH)2+M(M表示储氢合金),下列叙述正确的是( )
| A. | 工作时正、负极附近溶液的pH均不变 | |
| B. | 正极材料为MH,发生氧化反应 | |
| C. | 正极反应为:Ni00H+H20+e-=Ni(0H)2+0H- | |
| D. | 工作时每转移1mol电子,负极有1mol NiOOH被还原 |
17.燃烧2g液态C2H5OH生成CO2气体和液态H2O,放出热量的值为Q,则液态C2H5OH燃烧的热化学方程式正确的是( )
| A. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1)△H=-23Q kJ•mol-1 | |
| B. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1)△H=-Q/23 kJ•mol-1 | |
| C. | $\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(1)△H=-Q kJ•mol-1 | |
| D. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1)△H=+23 Q kJ•mol-1 |
15.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温下,44g CO2中含有2NA个碳氧双键 | |
| B. | 标准状况下,0.1mol Al3+含有的核外电子数为0.3NA | |
| C. | 室温下,1L pH=13的氢氧化钡溶液所含氢氧根离子数为0.2NA | |
| D. | 将1mol N2和3mol H2通入密闭容器中,在一定条件下充分反应,转移电子数为6NA |